在一项最新研究中,一个由奥塔哥大学生物化学系Peter Mace博士领导的研究团队揭示了人体内控制DNA包装的蛋白质——BAP1和ASXL1的三维结构。DNA通常被包裹在蛋白质上,被包装成高效的存储以控制哪些基因是活跃的。许多蛋白质帮助完成这个包装过程,而一旦这些蛋白质中的某个组分被扰乱,就有可能产生肿瘤。

图片来自Nat Commun
文献解读
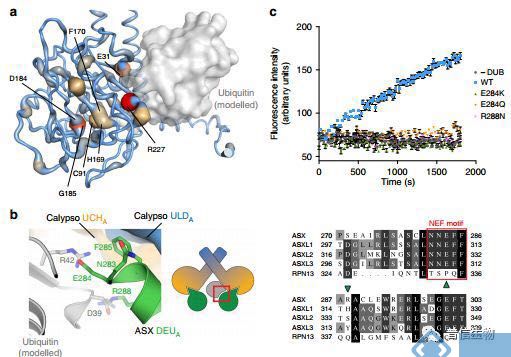
泛素与组蛋白2A赖氨酸119的连接是表观遗传标记被Polycomb去除的被压抑的发育基因的特征压制性-双胍基酶( PR - DUB )复合物。报告中表示晶体结构果蝇PR - DUB,揭示了双胍酶Calypso及其激活伴侣ASX形成一个2 : 2的复合体。双齿Calypso - ASX复合物是由两个二聚体生成的激活Calypso蛋白通过它们的盘绕区域。破坏钙离子二聚体界面不会影响固有的催化活性,但会抑制H2O 2作为一种核小体募集受损的后果,改变上的等效表面。
转录的表观遗传控制与所有真核生物相关,细胞生物学是许多人类疾病的基础。组蛋白的共价修饰(也称为组蛋白“标记”)是最成熟的机制之一表观遗传调控,对DNA的包装至关重要。因此,连接和去除组蛋白的酶在中,标记是最常见的失调基因之一癌症2,3。特别相关的是泛素与赖氨酸残基119上的组蛋白2A ( H2A ) ( H2Ak 119ub )在人类身上。H2AK119Ub是最普遍的组蛋白之一标记,并且估计发生在基因组范围内5 - 15 %的组蛋白4上。一般来说,H2AK119Ub是被压抑的特征发育基因,也与其他水平紧密相关组蛋白标记如赖氨酸甲基化和乙酰化。
图片来自Nat Commun
最近的研究已经表明UCH - L5结合和催化底物是由蛋白酶体相关适配器的Deubad推广rpn13,或被染色质重塑的debad抑制复合亚单位INO80G,每个结合中带有Debad合作伙伴稳定UCH - L5 ULD的不同构象域16,17。尽管UCH - L5 - Rn13复合物提供了PR - DUB催化模板和一些癌症衍生模型;在结晶过程中使用原位蛋白水解是可能的,生长可能已经去除了ASX Deubad的残留物310 - 340,或者ASX Deubad的剩余残基采用替代物晶体中的构象。任何一种情况都可能暗示的C末端区域的构象柔性程度,PR - DUB中错义突变的特征。
结论
Mace博士表示这些蛋白质的突变在很多肿瘤中都可见,如黑色素瘤、间皮瘤、肾癌和白血病等。他说接下来的工作将帮助我们明白肿瘤发展过程中这些网络的变化。BAP1突变尤其在间皮瘤中常见,而间皮瘤在人群中很罕见,由接触石棉导致,非常难治疗。这些新结构将帮助我们明白这两种蛋白如何协同作用以清除正常细胞中的DNA包装标记物,以及肿瘤中它们的功能如何受到干扰。这是首次捕捉到这些蛋白质的结构。研究人员揭示了果蝇的相同蛋白质的结构,而这些结构和人体的同类蛋白质很相似,但是其结构稍微简单点。下一步的工作就是完全揭示人体蛋白质的结构。
全国热线:400-168-1806

