浙江大学韩峰教授团队发现褪黑素改善低血糖应激诱导的脑内皮紧密连接损伤的重要机制
脑微血管内皮细胞在血液和中枢神经系统之间形成对维持正常脑功能至关重要的屏障。这种血脑屏障的完整性主要是通过围绕脑血管毛细血管内皮细胞维持中枢神经系统平衡的星形胶质细胞末梢之间紧密连接而实现的。
低血糖症是一种发生于糖尿病患者的常见症状。 患者可能会因低血糖而失去意识,并可能出现脑水肿甚至不可逆的脑损伤。低血糖破坏脑微血管紧密连接完整性可能会加重脑血管疾病,但低血糖时内皮细胞连接紊乱的机制仍然不甚了解。
TP53诱导的糖酵解和凋亡调节剂(TIGAR)在内皮细胞中表达,TIGAR可以促进通过戊糖磷酸途径的通量、激活线粒体呼吸链、提高NADPH水平,从而限制氧化应激对驱动细胞凋亡和自噬的影响。然而,TIGAR如何调节大脑内膜屏障和自噬仍不清楚。各种报道已经提出内皮自噬通过促生存或促死亡途径诱导信号传导。然而,迄今没有研究证实TIGAR在由代谢应激引发的自噬过程中对神经血管损伤有积极或消极作用。
褪黑激素是一种内源性产生的分子,在许多作用中都是强效的抗氧化剂和抗亚硝化剂。在其他实验报告中,褪黑激素已显示可防止脑血管内皮细胞损伤,并减少中枢神经系统水肿的积累。
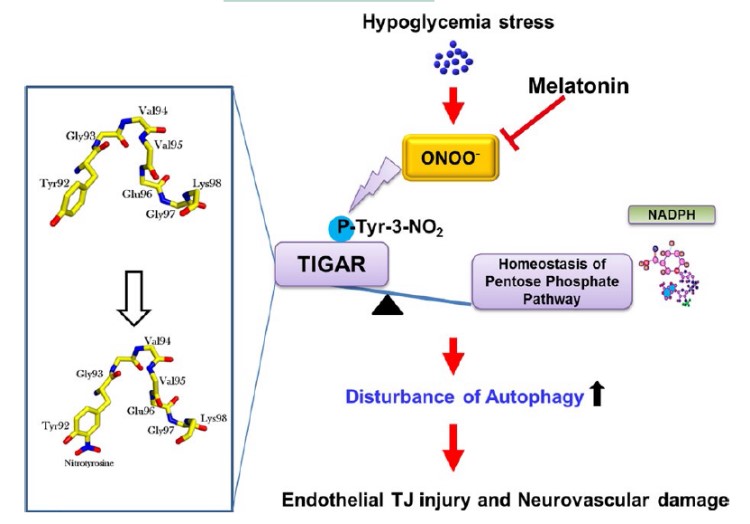
浙江大学韩峰教授团队于2017年5月在《pineal research》上发表了他们的最新研究成果,他们预计,褪黑素也可以预防由低血糖应激引起的内皮细胞紧密连接损伤,还阐明了褪黑素的保护作用的分子机制,及亚硝化应激在调节紧密连接完整性干扰期间自噬和TIGAR之间的串扰中的作用。文章中使用了汉恒生物的产品—mRFP-GFP-LC3自噬双标腺病毒。
结果
- TIGAR可以在小鼠低血糖损伤期间引起神经血管保护
使用tg-TIGAR小鼠用来评估TIGAR在体内胰岛素诱导的低血糖期间的保护作用,其在注射后12小时内血糖水平降低至2mmol / L。 TIGAR可以预防脑微血管低血糖性损伤(图1A-C),他们使用层粘连蛋白和claudin-5的免疫反应性来鉴定微血管内皮中的紧密连接。
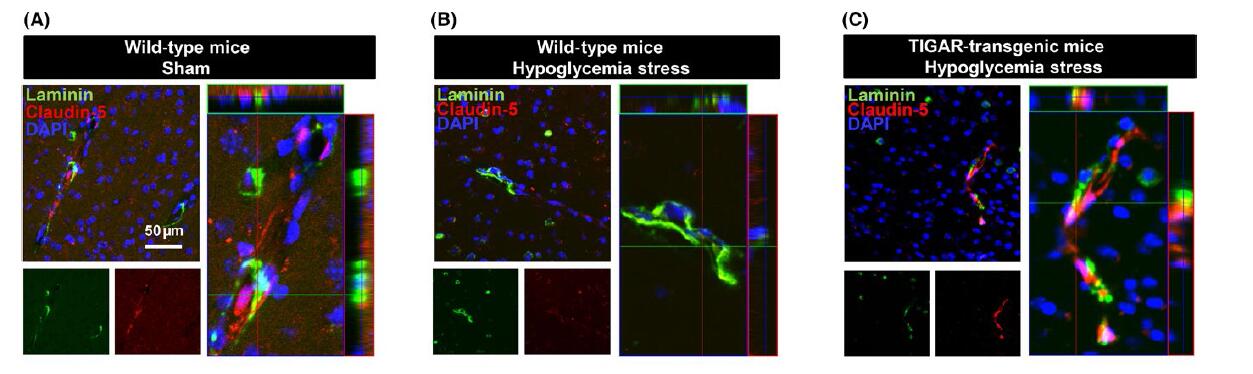
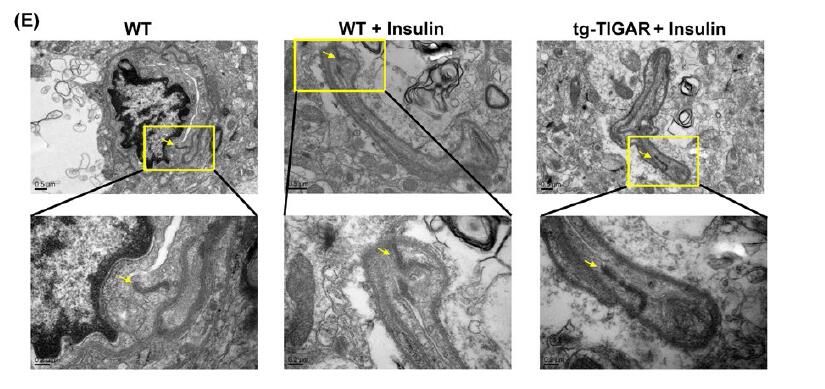
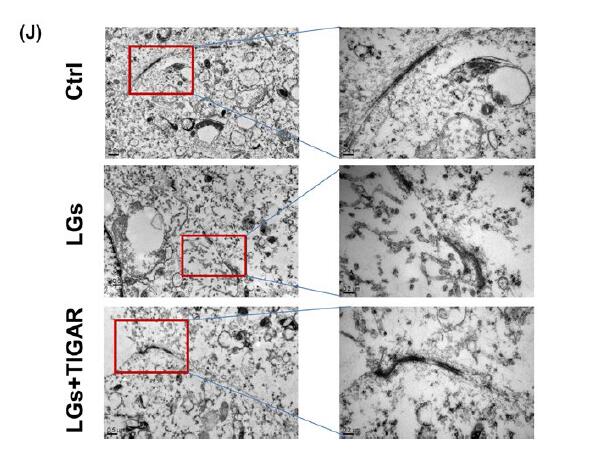
透射电镜显示低血糖C57BL / 6小鼠的大脑皮层微血管显示微血管和内皮细胞基底层的结构异常,而低血糖仅在tg-TIGAR小鼠中引起轻度微血管损伤。这些发现表明,低血糖期间脑血管的完整性取决于TIGAR对内皮紧密连接蛋白的保护作用。
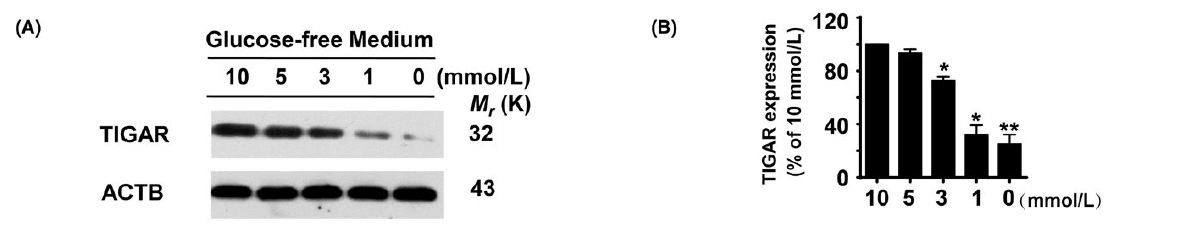
2.TIGER在紧密连接处的定位以及对低葡萄糖应激的反应
他们进一步研究了TIGAR在低血糖引起的人脑微血管内皮细胞应激中的作用。WB表明,内皮细胞中TIGAR蛋白水平的升高与培养基中葡萄糖浓度密切相关。
电子显微镜检查发现内皮细胞连接出现在对照细胞的细胞-细胞接触区域作为紧密连接的接触点,而它们的结构在低葡萄糖应激后受到干扰。如下图所示,慢病毒TIGAR转染阻止了细胞紧密连接的结构异常。
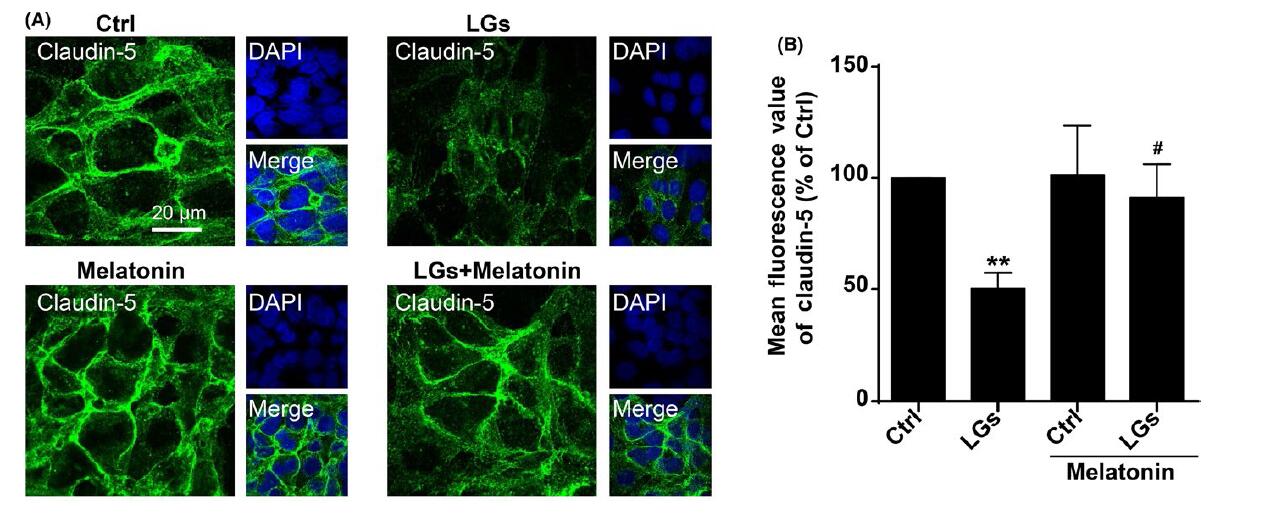
3.褪黑素对低糖应激致紧密连接损伤的保护作用
内皮细胞中紧密连接蛋白的表达对于保护它们的屏障功能是至关重要的。已有证据表明褪黑激素在脑损伤中的血管保护作用。免疫细胞化学分析显示低葡萄糖条件下脑内皮细胞claudin-5荧光值显着下降,相反,用褪黑激素处理内皮细胞培养物可抑制低葡萄糖应激过程中claudin-5的分解。
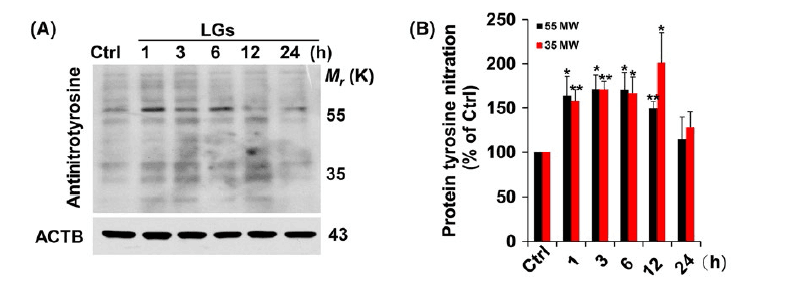
4.褪黑素降低了低血糖应激诱导的亚硝化应激
过氧亚**盐,并且是一种可引起细胞应激和炎症的活性氮类物质。因此,他们下一步调查亚低温应激是否与TIGAR功能障碍在低血糖期间的脑内皮细胞中有关。蛋白质印迹证实由低葡萄糖条件诱导的**-肌苷水平升高。
5.钙调蛋白依赖性TIGAR硝化和紧密连接损伤
由于钙调蛋白参与调节亚硝基-氧化还原平衡,因此它被研究作为TIGAR诱导的自噬的潜在抑制剂。
为了研究在低糖下亚硝化应激是否引起TIGAR功能障碍,在银染后,用胰蛋白酶和糜蛋白酶进行凝胶消化处理后,用ONOO-,27和SDS / PAGE凝胶斑点处理重组TIGAR蛋白,并通过纳米LC / MS / MS分析。
硝化导致带有3-**酪氨酸的肽发生质量转移。因此,TIGAR蛋白可以在Y92的酪氨酸残基处被硝化。
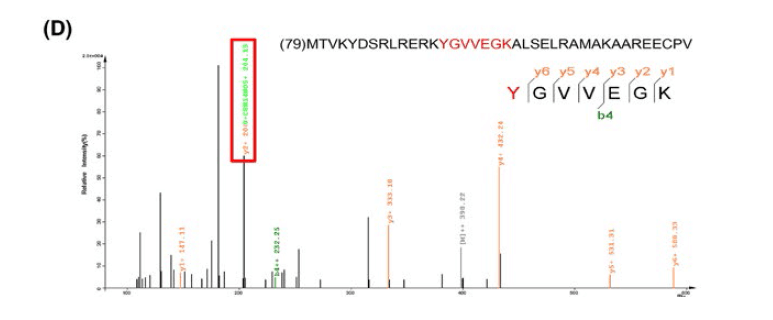
通过**酪氨酸的免疫沉淀,然后用抗TIGAR抗体进行免疫印迹,进一步证实了低糖应激诱导的TIGAR酪氨酸硝化。
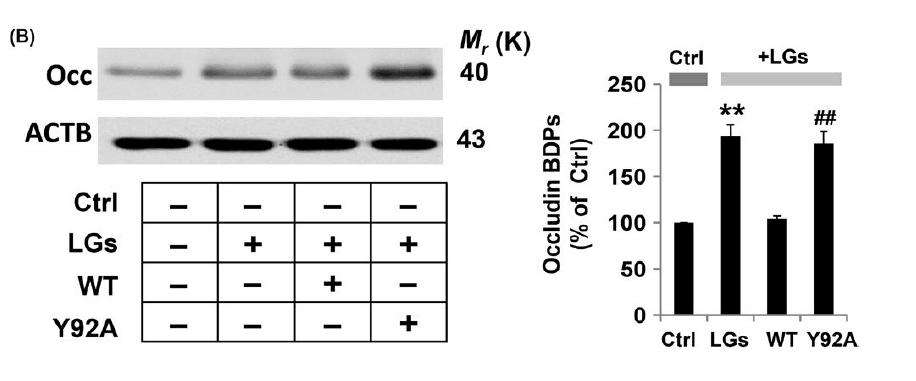
6.TIGAR中的突变体酪氨酸92对其紧密连接的保护功能至关重要
为了评估形成催化三联体的TIGAR中的3个氨基酸是否危及TIGAR活性,通过酪氨酸92的硝化位点中的点突变构建了突变体TIGAR。TIGAR硝化位点突变取消了HBMECs暴露于低葡萄糖条件后occludin分解的保护作用。
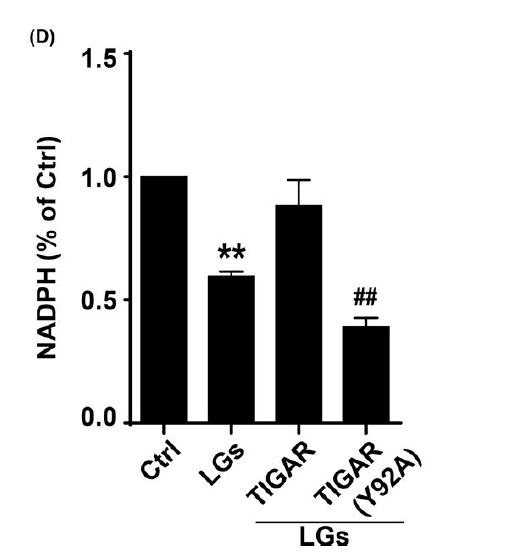
TIGAR的过度表达进一步提高了NADPH水平,这意味着PPP通量增加,而这一点被突变TIGAR(Y92A)逆转。因此,TIGAR酪氨酸92对其正常功能至关重要,并且TIGAR硝化位点的突变足以阻止增加的PPP通量并取消TIGAR对紧密连接完整性的保护。
7.TIGAR对低糖应激下自噬的抑制作用
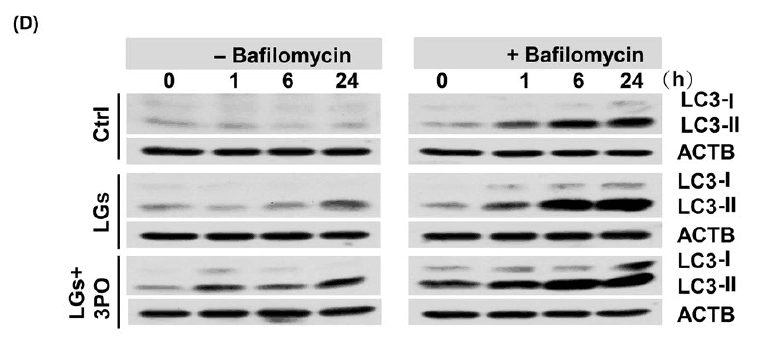
他们接下来探讨了TIGAR与内皮细胞内皮细胞紧密连接蛋白破坏过程中过度自噬之间的关系。 通过用TIGAR质粒或重组人TAT-TIGAR蛋白质转染内皮细胞增加TIGAR活性减少低葡萄糖暴露期间的LC3-II积聚。
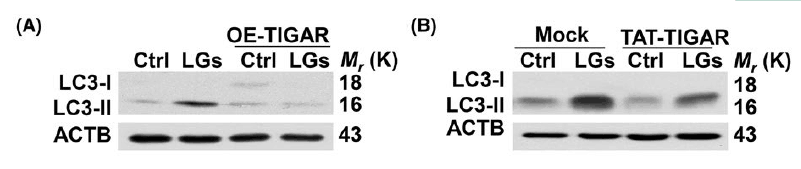
免疫印迹显示在低葡萄糖培养基中存在巴弗洛霉素A1时LC3-II积累进一步增加,证实TIGAR抑制剂引起对低葡萄糖诱导的自噬流通障碍的抑制作用。
8.自噬诱导的低糖应激时的紧密连接损伤干扰
他们接下来评估低葡萄糖条件下自噬的激活是否促进内皮损伤或存活,细胞质LC3-I是LC3-II脂化的自噬指数。HBMECs中的LC3-II蛋白水平增加,与葡萄糖水平下降或增加低葡萄糖暴露时间接近成比例。表明低葡萄糖条件诱导脑内皮细胞的自噬。
用表达mRFP-GFP-LC3的腺病毒载体转染内皮细胞以研究自噬体形成。低葡萄糖应激时自噬溶酶体或自吞噬体增加,增强了自噬通量。此外,由溶酶体蛋白酶抑制剂增加LC3荧光斑点的数量,溶酶体的参与明显增加,这表明自噬诱导或自噬通量响应随低糖改变而增加。
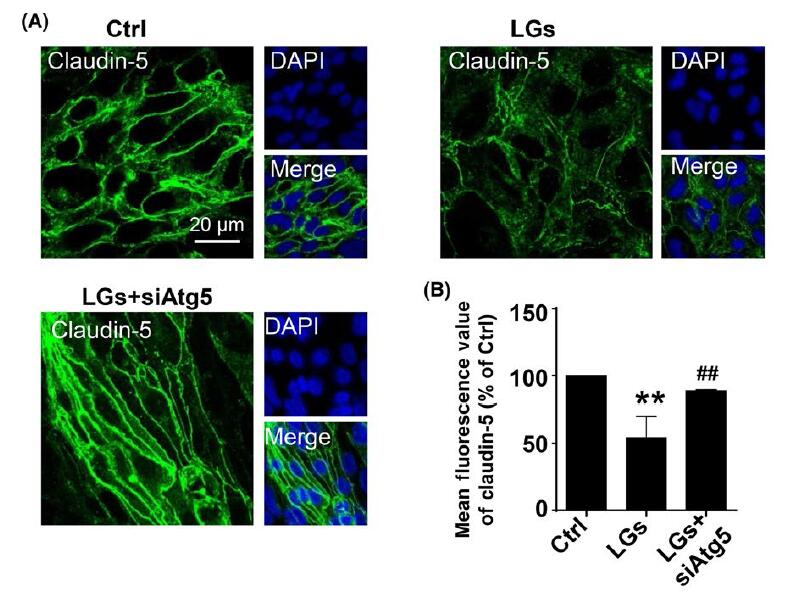
如下图所示,沉默自噬相关蛋白5显著降低了低糖培养基中HBMECs中LC3-II的积累。此外,免疫细胞化学测定显示Atg5沉默有效地降低了低葡萄糖诱导的claudin-5降解。在相同的背景下表达occludin时也观察到类似的结果。
9.褪黑激素对低糖应激下自噬的抑制作用
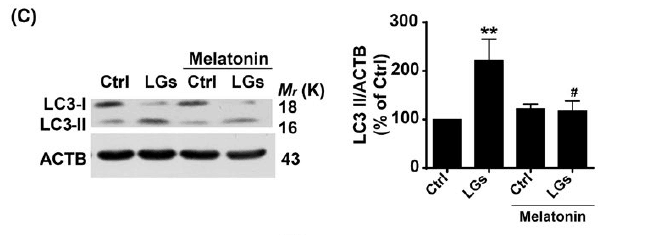
此外,在暴露于低糖并和褪黑素孵育24小时后的HBMEC的LC3-II积累以及点状形成减少。在相同的情况下,褪黑素存在降低了ONOO-水平。而使用褪黑激素抑制(SIN-1)诱导后自噬体形成减少。这些数据暗示亚硝化应激在调节紧密连接完整性干扰期间自噬和TIGAR之间的串扰的关键作用。
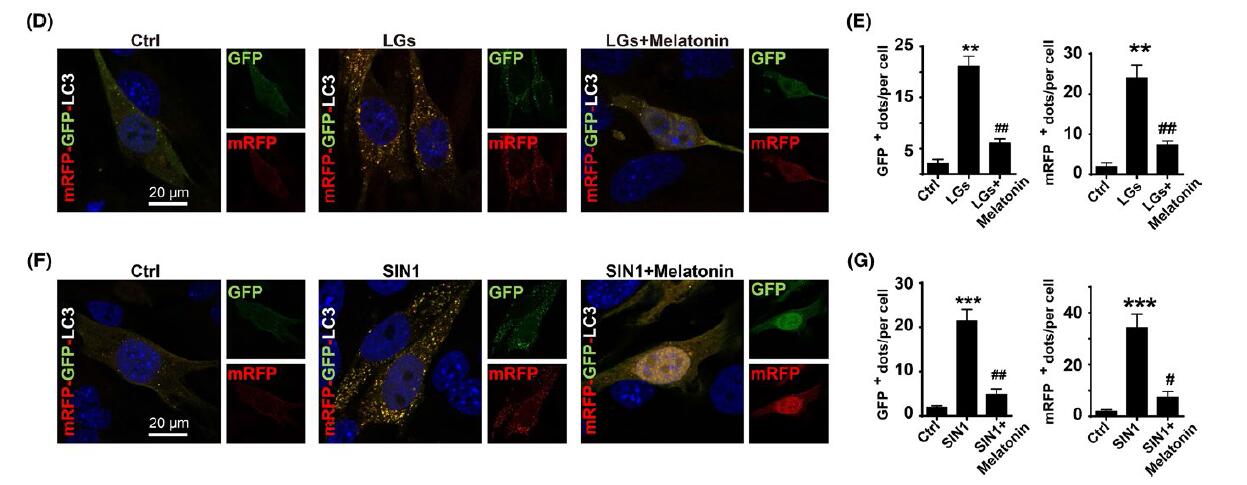
总之,韩峰教授团队的数据阐明了一种通过TIGAR调控自噬调节的新途径,可以提供对硝化应激的神经保护作用。 他们提供了褪黑激素对脑内皮细胞紧密连接的保护作用的详细分子机制,并提示这种吲哚对严重低血糖引起的神经血管损伤具有转化潜能。
