
期刊:Cell Death & Differentiation
影响因子:13.7
主要技术:scRNA-seq;胰岛β细胞;Wolfram syndrome
导语
Wolfram综合征(WS)是一种罕见的常染色体隐性遗传病,以尿崩症、糖尿病、视神经萎缩和耳聋为特征。WS的标志性特征之一是青少年发病糖尿病,平均发病年龄为6岁(3周- 16岁)。由于胰岛β细胞的选择性破坏和功能衰竭,大多数WS患者需要胰岛素治疗。然而,由于缺乏对其发病机制的了解,目前除了提供外源性胰岛素外,没有可用的治疗方法来逆转这种疾病的进展。
WS主要由WFS1的致病变异引起,Wolfram基因(WFS1)编码一种在内质网膜上具有9个跨膜结构域的蛋白,该蛋白在胰岛β细胞和大脑中高度表达。对WS患者胰腺的分析表明,胰岛β细胞存在选择性损失。位于内质网膜上的WFS1在蛋白质从内质网转运到高尔基体中起作用,它直接与包括胰岛素原在内的一系列囊状货物蛋白相互作用。WFS1缺陷小鼠在葡萄糖刺激下表现出胰岛素加工减少和胰岛素分泌受损。胰岛β细胞中WFS1的功能丧失导致胰岛β细胞死亡后内质网应激增加和未折叠蛋白反应(UPR)的激活。这些发现表明WFS1缺陷胰岛β细胞的细胞应激增加。异常应激颗粒的形成在多种疾病中起着关键作用,真核起始因子2 (eIF2)在α亚基上的磷酸化可通过包括PERK在内的四种不同的激酶启动ISR,从而诱导应激下UPR的激活。一旦ISR被触发,限制了AUG启动的mRNA翻译,诱导应激颗粒的组装和细胞死亡。因此WFS1可能控制ISR和随之而来的应激颗粒形成。
由于缺乏适当的人体模型,对WS发病机制的了解受到限制。为了阐明WFS1缺乏导致胰岛β细胞衰竭的机制,通过hESCs衍生的胰岛来表征WFS1缺乏作为人胰岛β细胞衰竭模型。结果表明,WFS1缺陷驱动胰岛β细胞命运进入应激轨道,导致功能失败。使用ISR抑制剂ISRIB治疗可增加胰岛的比例并减轻细胞凋亡。研究为WS糖尿病胰岛β细胞紊乱提供了机制见解,并提出了一种潜在的ISRIB治疗方法。
技术服务
scRNA-seq;胰岛β细胞;Wolfram syndrome
研究结果
1. 单细胞测序揭示胰岛β细胞在内的胰腺内分泌细胞亚群
我们利用含有WFS1缺陷的sc -胰岛作为体外逐步分化hESCs分化的疾病模型(图1A),同时,利用CRISPR/Cas9敲除策略建立了WFS1敲除hESCs报告细胞系(WFS1−/−)。采用qRT-PCR检测ES期到胰岛期WFS1的表达水平,我们发现WFS1在WT细胞系的分化过程中逐渐表达,这与报道的WFS1在人原代胰岛β细胞中的高表达一致(图1B)。对WT和WFS1−/−胰岛进行scRNA-seq分析(图1C)。WFS1−/−胰岛中WFS1的表达大大减少,证实了WFS1的完全敲除(图1D)。无监督聚类分析确定了WT和WFS1−/−中8个不同cluster(图1E),包括β细胞(表达INS、PCSK1和G6PC2)、α细胞(表达GCG)、δ细胞(表达SST)、ε细胞(表达GHRL)、胰腺祖细胞(表达SOX9)、增殖细胞(表达MKI67)、EC细胞(表达FEV)和多激素内分泌细胞(共表达GCG和INS)(图1F)。
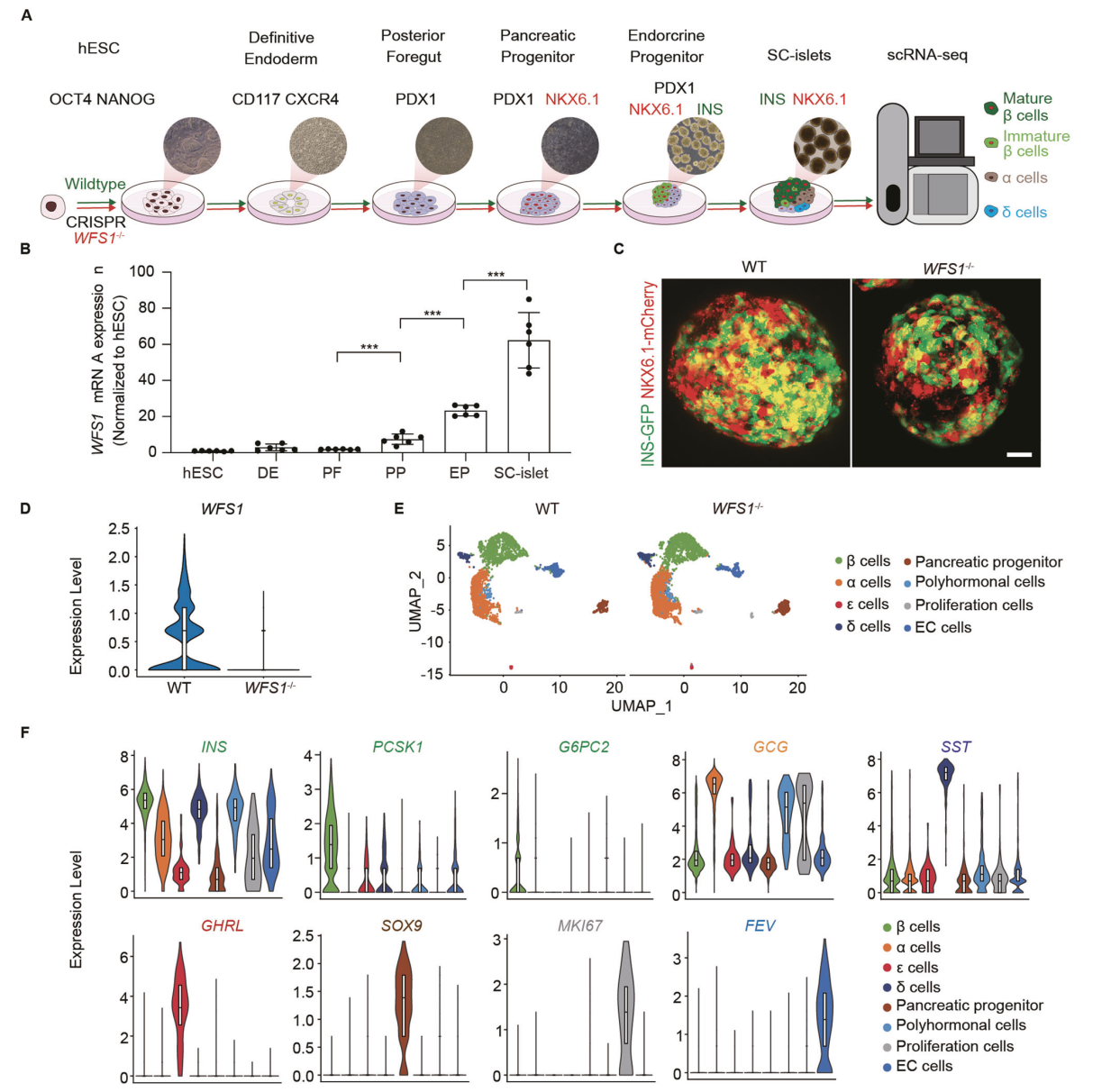
图1
2. 拟时序分析揭示了应激和成熟的β细胞亚群
为了研究WFS1在胰岛β细胞异质性中的功能,将所有合并的胰岛β细胞重新聚类为两个主要的β细胞亚群(图2A)。我们根据top上调基因鉴定了这两个亚群,并将其定义为成熟β细胞和应激β细胞。成熟β细胞的特点是高表达成熟胰岛β细胞标志物,如INS、CHGA、G6PC2和PCSK1,而应激β细胞则高表达应激相关标志物,如XBP1、ATF4、ATF6、DDIT3、HERPUD1、EIF2AK1、EIF2AK2和EIF2AK4(图2B)。我们共同揭示了成熟β细胞和应激β细胞两个亚群的异质性。此外,通过使用Monocle拟时序分析在胰岛β细胞中发现了两个不同的分支(图2C)。通过分子动力学来区分这两个分支,基因表达动态分析主要集中在前500个差异表达基因上(图2E)。我们发现,应激相关标记在1分支上高表达,如ATF4和JUN,而胰岛β细胞身份和成熟标记在2分支上高表达,如INS、INS- igf2、CHGA和CDKN1C。基于以上特征,我们推断1分支为应激状态,2分支为成熟状态(图2C)。胰岛β细胞总分支为两种终末分化的细胞类型。大多数应激β细胞位于1分支(应激分支)的末端,与应激β细胞群一致(图2D)。同时,我们评估了两个命运分支中与胰岛β细胞标志物和应激相关标志物相关的基因表达模式。WFS1沿成熟分支高表达,表明WFS1的功能与β细胞成熟相关。而ATF4、G3BP1和ATF6的表达沿胁迫分支升高,但沿成熟分支明显降低(图2F)。总之,通过单细胞转录组学分析,胰岛β细胞的组成被鉴定为两个不同的亚群,包括成熟和应激β细胞,具有两种不同的命运轨迹。
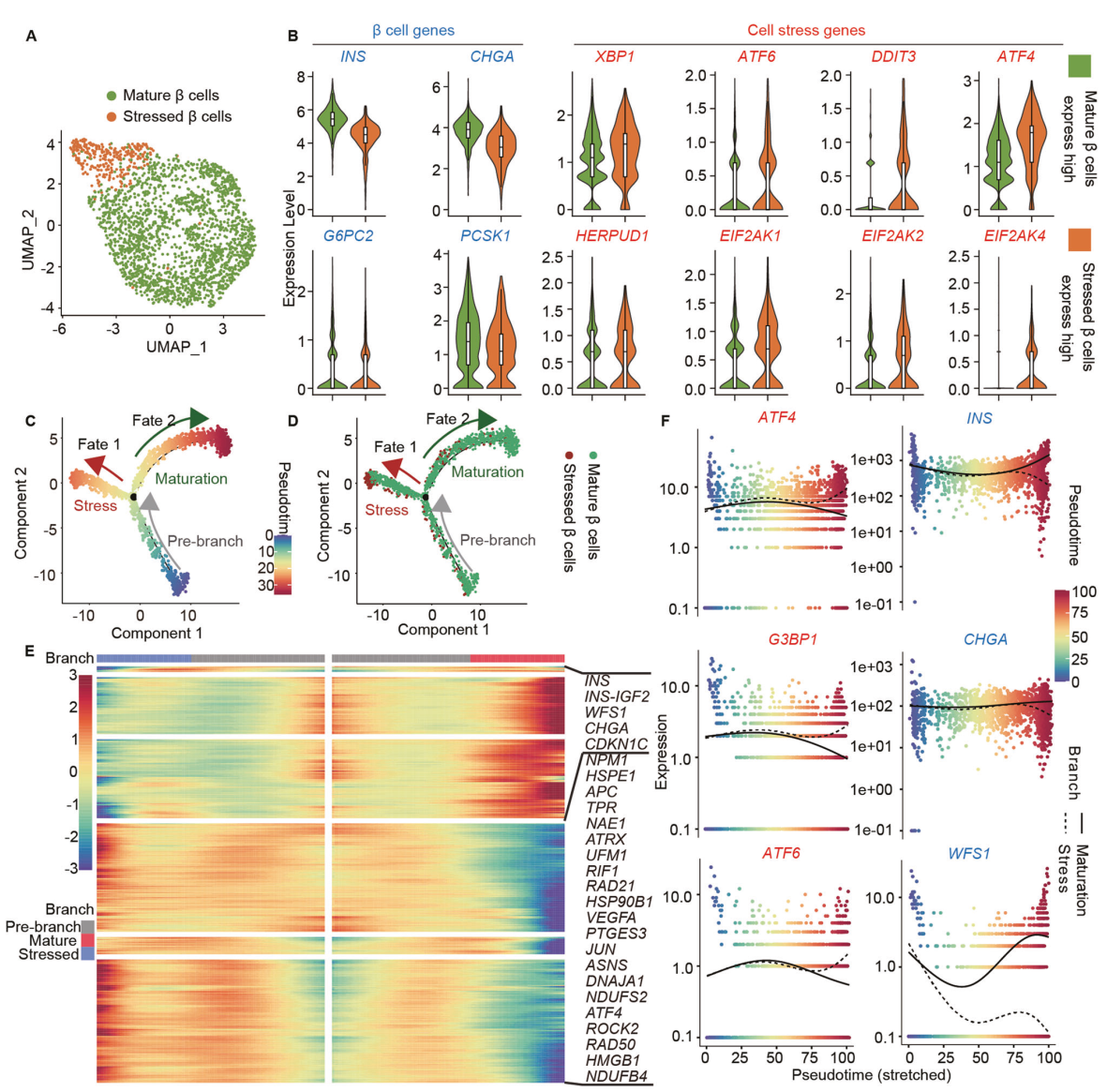
图 2
3. WFS 1缺乏导致β细胞进入功能成熟缺乏的应激分支
值得注意的是,WFS1−/−胰岛β细胞主要处于应激状态。分支沿拟时序向成熟分支方向停滞(图3A)。接下来,我们评估了WT和WFS1−/−胰岛β细胞在三个细胞命运分支中的比例(图3B)。WT和WFS1−/−胰岛β细胞分别占分支前细胞总数的58.6%和41.4%。在成熟分支中,WT细胞的比例达到86.5%,而在应激分支中,WFS1−/−细胞的比例占总细胞的92.3%(图3B),这与WFS1−/−SCislet β细胞向成熟分支的停滞轨迹一致。同时,我们对WT和WFS1−/−胰岛β细胞的转录组学变化进行了更深入的分析,以检测分子变化。其中有2701个上调基因和446个下调基因(图3C)。与胰腺β细胞成熟和功能相关的基因,如INS、NKX6.1、PCSK1和CDKN1C在WFS1−/−胰岛β细胞中下调,细胞应激相关基因如ATF4、JUN、ROCK2和HSP90B1在WFS1−/−sc -胰岛β细胞中上调(图3C,3D)。相比之下,我们对scRNA-seq数据的分析显示,WFS1−/−胰岛β细胞表现出缺乏成熟的应激细胞命运。为了验证这一点,我们在两种细胞中进行了GSIS实验。葡萄糖刺激后与WT相比,WFS1−/−胰岛素分泌明显减少(图3E, F)。并且在WFS1−/−胰岛中测量每个细胞的胰岛素含量,结果显示与WT sc -胰岛相比,细胞内胰岛素含量显著降低(图3E, G)。我们的结果表明,WFS1是促进β细胞走向成熟轨迹所必需的。
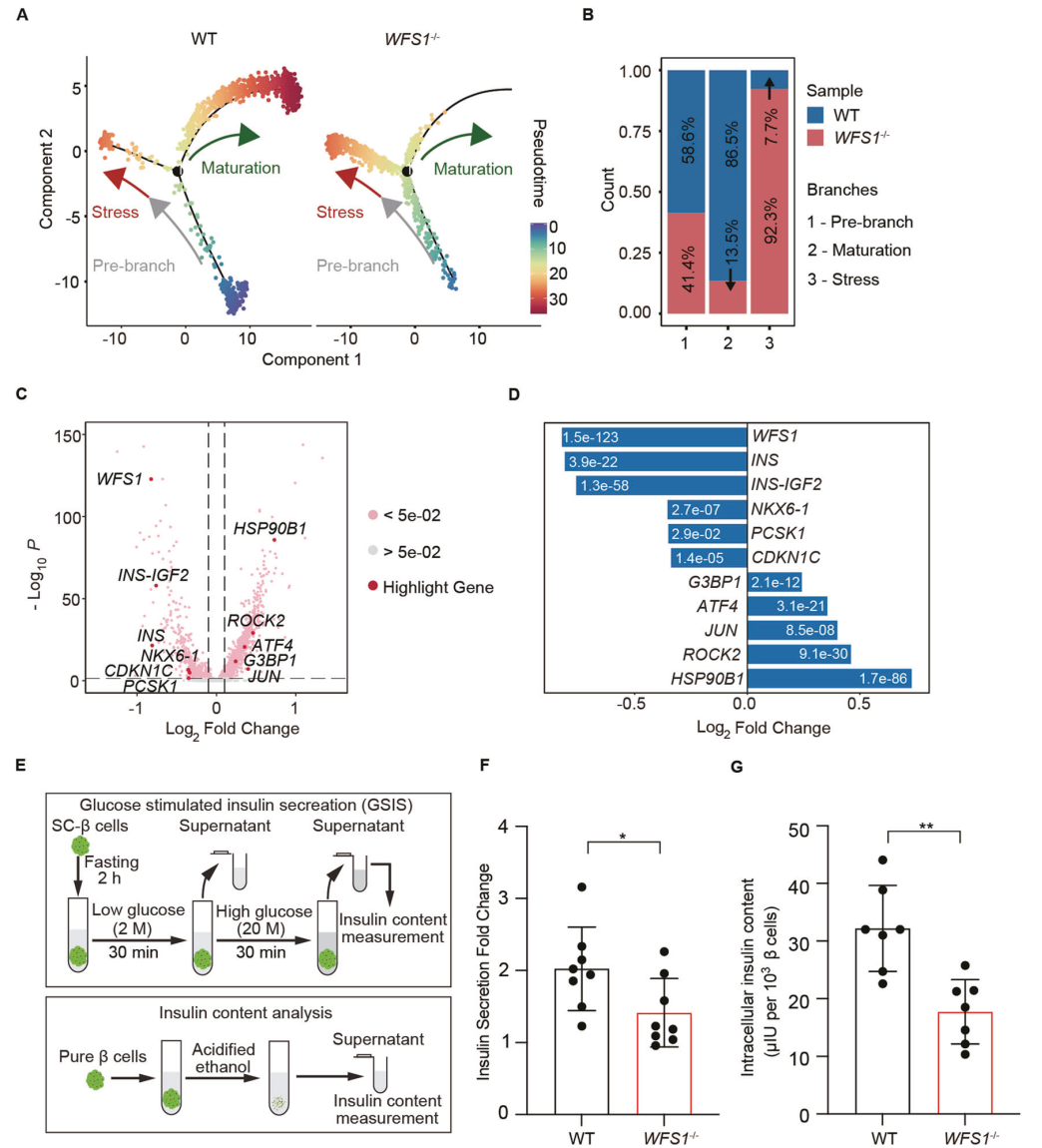
图 3
4. WFS 1缺乏诱导β细胞中的ISC
为了确定调节WFS1−/−胰岛β细胞功能衰竭的信号通路,对胰岛β细胞进行了GSEA分析,并确定了富集程度最高的通路。在WFS1−/−胰岛β细胞中,与细胞应激反应相关的如PERK和HSP90在通路富集分析的前25条上调通路中显著富集(图4A)。为了进一步验证WFS1−/−胰岛β细胞中的下调翻译,我们比较了eIF2相关基因的表达。WFS1−/−胰岛β细胞内的差异基因中有54个与eIF2信号通路相关被富集(图4B)。eIF2信号通路相关基因相对表达变化对比热图显示,75%基因下调,表明ISR激活(图4C)。当翻译起始被应激反应抑制时,就会形成应力颗粒。WFS1−/−胰岛β细胞内的差异基因中有21个与核心应激颗粒基因相关被富集(图4B)。值得注意的是,21个与核心胁迫颗粒基因相关的基因,其中包括所有7个被描述为胁迫颗粒组装“必需”的基因(图4D)。综上所述,我们的结果表明,WFS1缺失激活胰岛β细胞的ISR,并导致翻译的整体衰减。为了进一步验证ISR在WFS1−/−胰岛β细胞中的激活作用,我们检测了ISR相关基因的表达。与WT相比,WFS1−/−胰岛β细胞中ISR相关基因的表达高度增加(图4E)。通过WB检测PERK/eIF2信号通路关键因子的表达水平,发现与WT相比,WFS1−/−胰岛β细胞中eIF2α的磷酸化水平显著升高,PERK和ATF4蛋白水平也显著升高(图4F,G)。同时,我们采用免疫印记法检测应激颗粒中必需成分G3BP1的表达。与WT相比,WFS1−/−胰岛β细胞应激颗粒平均强度显著升高(图4H,I)。
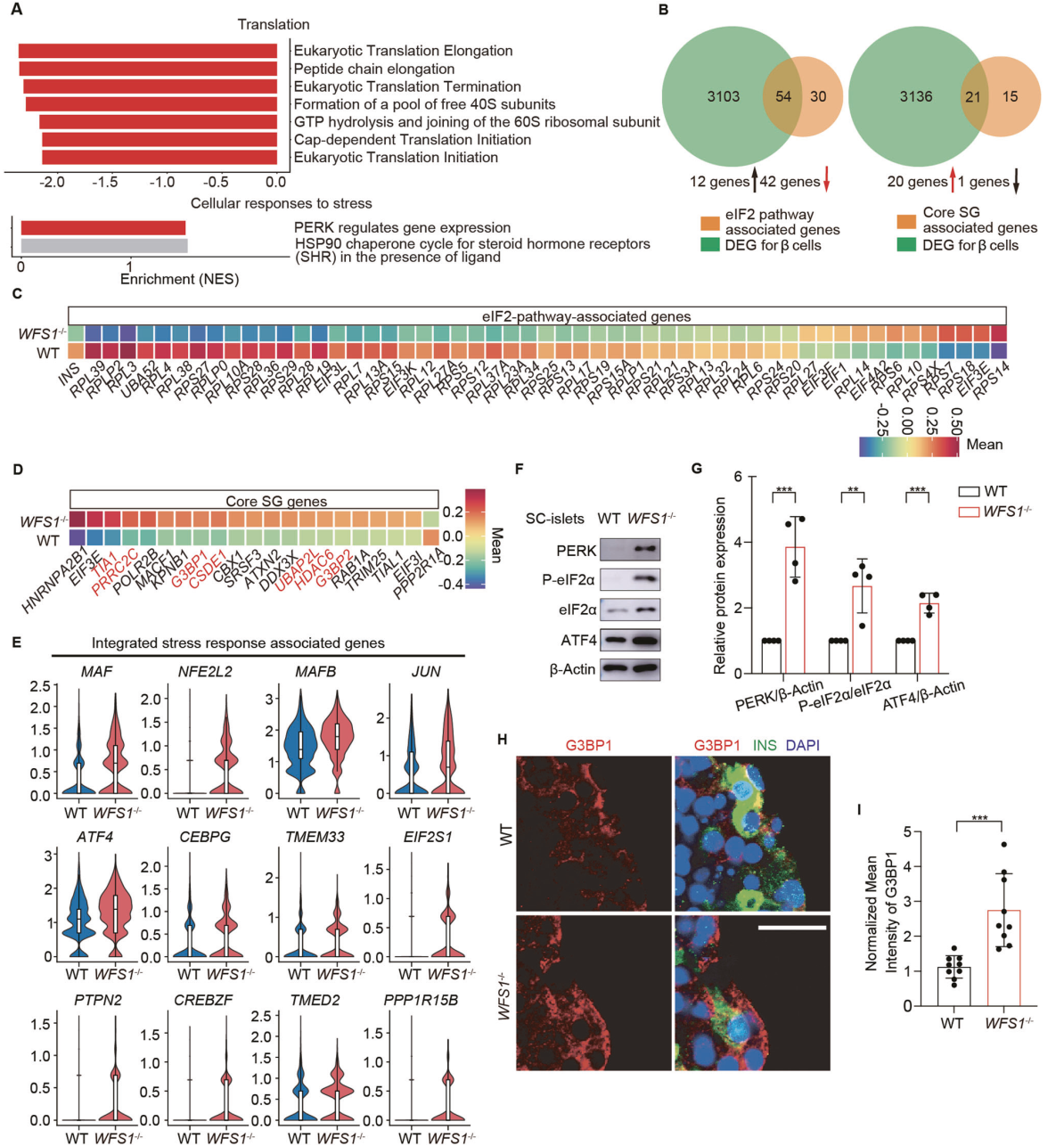
图 4
5. ISR抑制剂逆转胰腺β细胞衰竭
为了研究抑制ISR是否可以用于治疗WS的胰腺β细胞衰竭,使用ISR抑制剂ISRIB在细胞水平进行验证(图5A)。与对照相比,经ISRIB处理的WFS1缺陷胰岛中G3BP1的平均强度显著降低(图5B,C)。由于活化的ISR抑制蛋白合成,我们通过OPP标记进行新生多肽合成试验,以评估总蛋白合成。结果经ISRIB处理的WFS1缺陷胰岛中减少的总蛋白合成显著恢复(图5D,E)。此外,我们发现,与对照相比,经ISRIB处理的WFS1−/−胰岛中INSGFP NKX6.1-mCherry双阳性胰岛β细胞的比例显著增加(图5F,G)。接下来用100 nM ISRIB或对照治疗WFS1缺陷胰岛2天(图5H)。与对照物相比,经ISRIB处理的胰岛中G3BP1的平均强度显著降低,表明应激颗粒的形成减少(图5I,J)。与此同时,经ISRIB处理的WFS1缺陷胰岛中总蛋白合成也得到恢复(图5K,L)。同时经ISRIB处理的胰岛β细胞凋亡显著减少(图5M)。这些结果表明,抑制ISR能逆转胰腺β细胞损失。
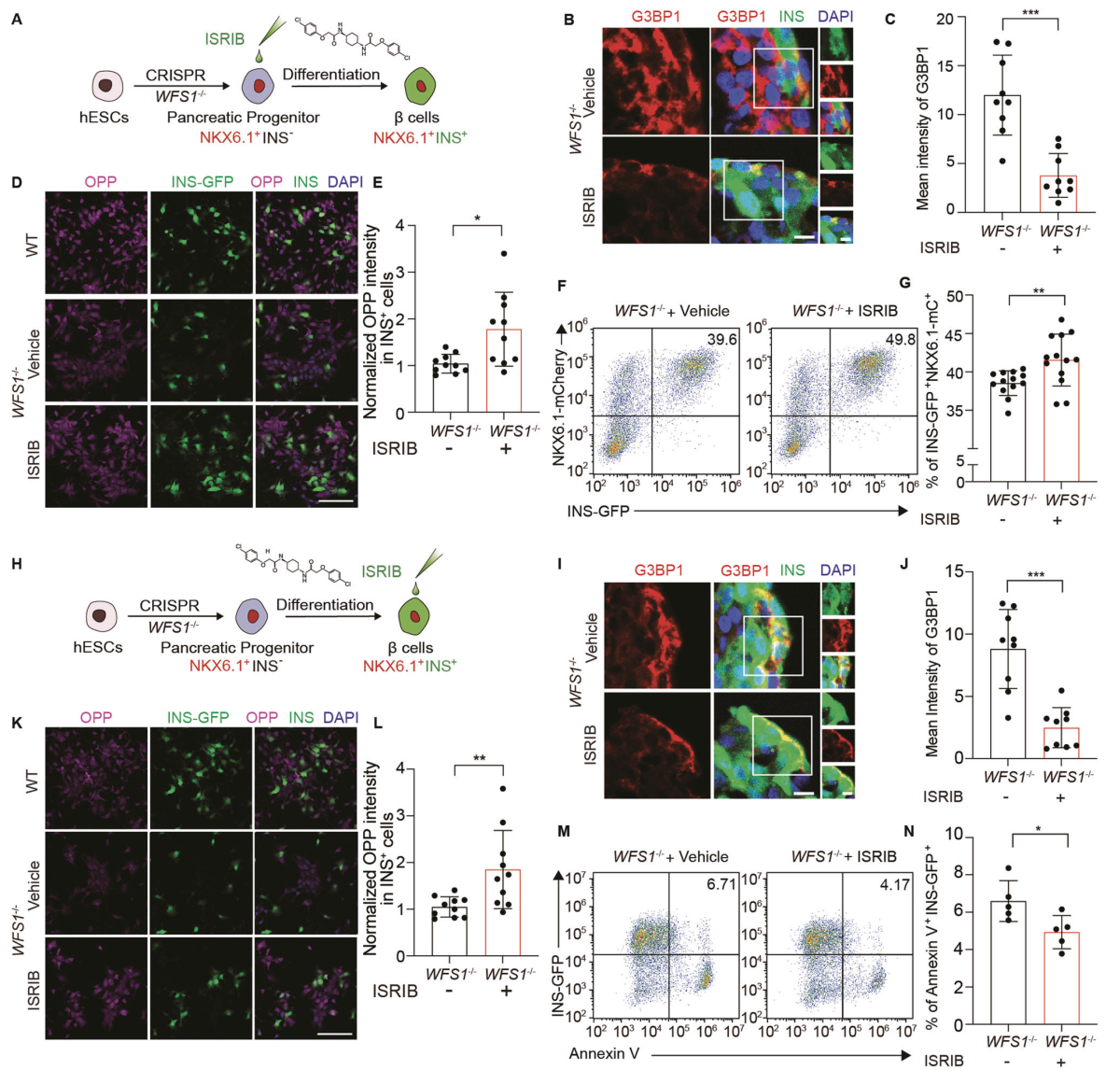
图 5
6. ISR抑制剂改善WFS1胰腺条件敲除小鼠的葡萄糖稳态
为了验证ISRIB在体内的有效性,我们将WFS1-flox小鼠与Pdx1-Cre小鼠杂交,产生胰腺WFS1条敲小鼠,腹腔注射给药2.5 mg/kg ISRIB或对照物(图6A)。我们观察到,在8周龄时,与对照组相比,接受ISRIB治疗的WFS1缺陷小鼠的空腹血糖水平显著降低(图6B)。对小鼠胰腺进行了胰岛素免疫染色。我们发现,与对照组相比,ISRIB处理的CKO小鼠胰腺β细胞的胰岛素强度和胰岛素含量显著恢复,与WT小鼠相似(图6C-E)。OPP标记显示,ISRIB治疗显著恢复了CKO小鼠受损的总蛋白合成,并减少了应激颗粒的形成(图6F-H)。此外,腹腔内糖耐量试验显示,与给药小鼠相比,ISRIB治疗显著改善了CKO小鼠的糖耐量(图6I,J)。同时,我们在体内用GSIS检测胰岛素分泌,与对照组相比,经ISRIB处理的CKO小鼠在高糖刺激下胰岛素分泌明显改善(图6K)。值得注意的是,WT和ISRIB处理的CKO小鼠在高糖刺激下的胰岛素分泌没有显著差异(图6K)。这些结果表明,ISRIB可以逆转β细胞衰竭,改善体内葡萄糖稳态。总的来说,ISRIB可用于治疗WS糖尿病的胰腺β细胞衰竭和功能(图6L)。
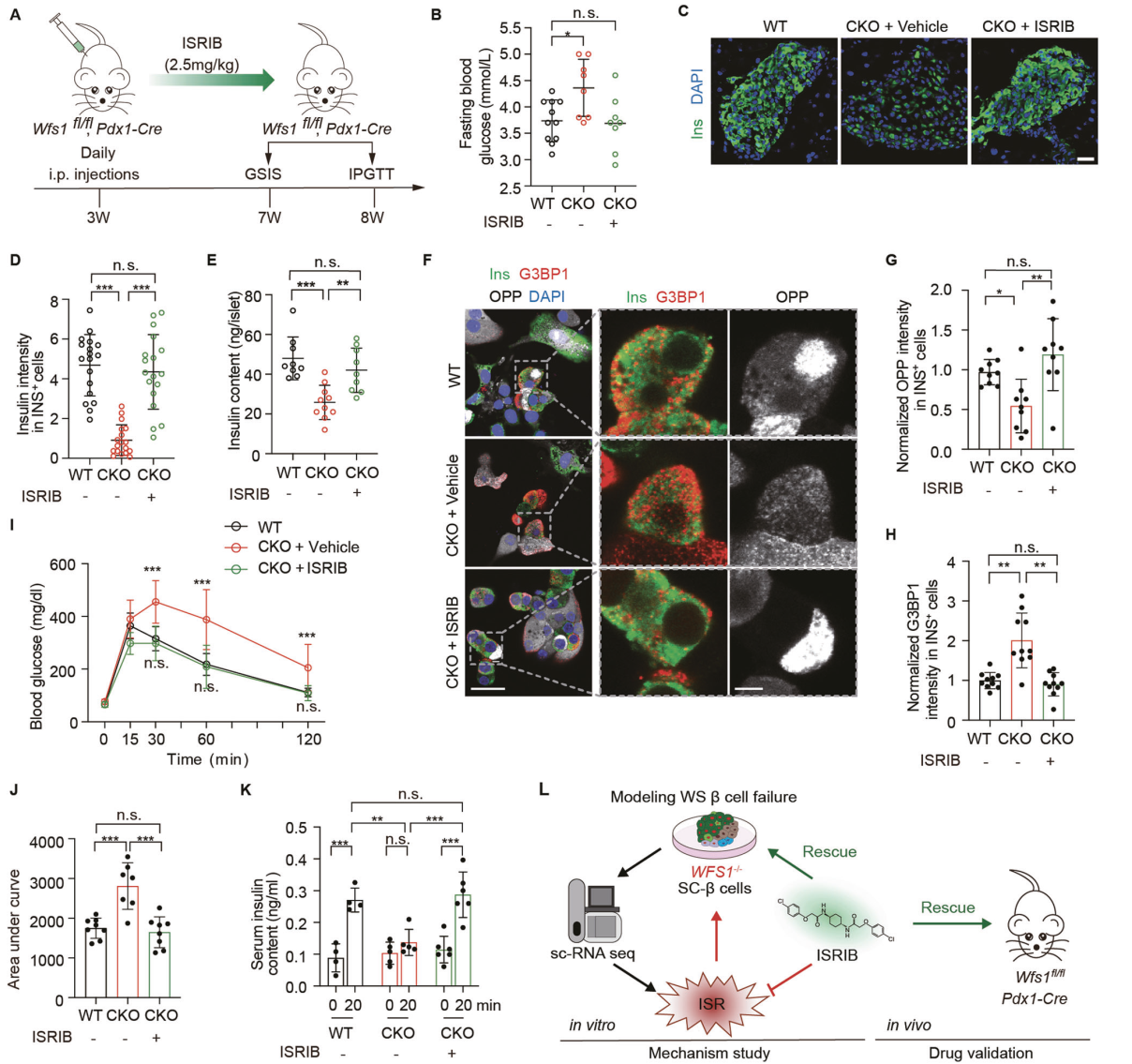
图 6
导语
Wolfram综合征是一种罕见的常染色体隐性遗传病,许多患者过早死亡。然而,由于缺乏合适的人类模型,Wolfram综合症的致病机制尚不明确,导致目前尚无治疗方法可延缓、停止或逆转Wolfram综合征的发展,因此迫切需要新的Wolfram综合症模型进行深度探索。研究人员利用Wolfram综合症体外和体内模型,揭示了ISRIB在缓解胰岛β细胞功能衰竭中所发挥的作用,为Wolfram综合症的治疗提供了新思路。利用单细胞转录组测序技术研究了致病基因WFS1对胰岛β细胞的影响,并发现ISR抑制剂ISRIB能缓解WFS1缺失的胰岛β细胞的功能衰竭,且在WFS1条件性敲除小鼠中也能发挥作用。此研究为治疗WS糖尿病提供了新的药物选项。华大智造DNBelab C系列单细胞建库平台为该研究提供了单细胞测序支持。
参考文献:
Hu R, Chen X, Su Q, Wang Z, Wang X, Gong M, Xu M, Le R, Gao Y, Dai P, Zhang ZN, Shao L, Li W. ISR inhibition reverses pancreatic β-cell failure in Wolfram syndrome models. Cell Death Differ. 2024 Mar;31(3):322-334. doi: 10.1038/s41418-024-01258-w. Epub 2024 Feb 6. PMID: 38321214; PMCID: PMC10923889.

