6000份样本告诉你:患上抑郁症,问题或出在肠道
肠道和大脑,这两个器官看起来风马牛不相及。虽然越来越多的研究发现,肠道和中枢神经系统是协同工作的,但由于其背后机制无法说清,因此“肠脑轴”被提出很长时间以来,都被视为“玄学”一般的概念。
不过近日,来自芬兰的一份样本量达6000多人的研究表明:肠道中的某些微生物特征或许与抑郁症相关,其背后的传导机制则与基因有关。
这个研究,似乎又为“肠脑轴”概念增添了新的证据。
肠道菌群影响健康。

你能想到反复感冒、口臭腹胀、腹泻便秘、焦虑抑郁甚至出现痤疮湿疹这些健康问题,可能都与肠道菌群密切相关吗?
人类和其他哺乳动物一样,身体被包括细菌、病毒和真菌在内的数万亿微生物占据,这些微生物大部分栖息在人类的肠道中。
人体肠道内的微生物超过99%都是细菌,细菌大约有10万亿个。这些细菌大致可以被分为有益菌、有害菌和中性菌三类。”天津市精神卫生中心心境障碍科主任医师王立娜介绍。
肠道菌群神通广大,与人类健康息息相关。肠道菌群能调节免疫系统,一旦紊乱,会导致各类代谢疾病,甚至关乎大脑健康和改变宿主基因表达。”王立娜介绍,其中“肠脑轴”的说法近年来已被越来越多的研究所证实。
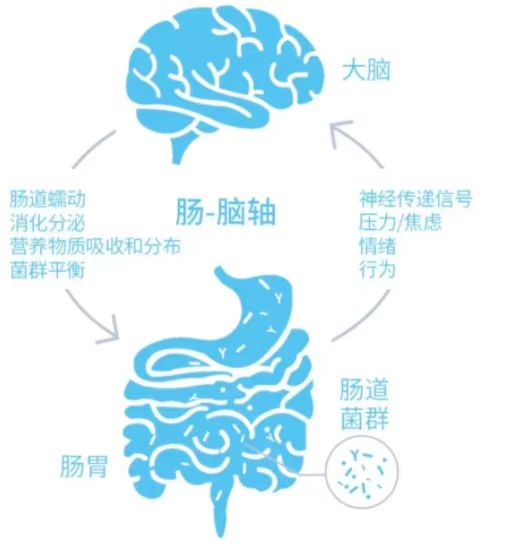
“肠脑轴”并非是“一根直肠通大脑”,它们之间的联系是通过中枢神经系统和胃肠道之间的生化信号交流进行的,是双向信号沟通网络。
肠道菌群与中枢神经系统、神经内分泌系统和神经免疫系统、交感神经系统和副交感神经系统以及肠道神经系统一起,通过激素和神经回路实现信息交流,调节并控制着许多生理和行为现象。
“肠脑轴”的大网络还与很多其他疾病的发生有关,例如:肠道微生物可通过对甲状腺激素和免疫功能的影响,导致多种甲状腺疾病的发生;同时肠道菌群也是介导肥胖、糖尿病、甚至抑郁症和帕金森病的重要致病机制;在动物研究中发现,无菌小鼠容易表现出自闭症样的社交行为缺陷。
什么在“主宰”肠道菌群
有数据表明,体魄强健的人肠道内有益菌的比例达到70%,普通人则是25%,便秘人群仅有15%左右。
那么是什么“主宰”了肠道菌群的构成?
不同的菌群对不同的食物有不一样的偏好,因此人类短期和长期的饮食变化都影响肠道微生物平衡生态,即日常膳食决定了人类肠道菌群组的组成。”王立娜说。
例如普氏杆菌喜欢碳水化合物和单糖,拟杆菌属喜欢某些脂肪,而双歧杆菌喜欢膳食纤维。因此饮食的改变会导致菌群物种数量的相应变化。“因为菌群之间互相存在竞争,而竞争决定哪一个微生物在其中生存。”王立娜介绍,如果我们每天习惯吃碳水化合物而不怎么吃蔬菜,那么我们体内喜欢这类碳水化合物的菌群就会越来越多,而喜欢膳食纤维的菌群则有可能被饿死。
以色列魏茨曼研究所科学家在2018年的英国《自然》杂志上发表的一项研究表明,人体肠道菌群的构成主要由饮食和生活方式决定,遗传因素的影响很小。也就是说,即使没有血缘关系,住在同一个屋檐下的人肠道菌群构成也会高度相似。
不过,除了膳食这个主要的外在因素,基因是对肠道菌群影响最大的内在因素,一直以来,关于个体肠道菌群之间的差异是受宿主基因型决定还是受膳食决定一直存在争议。
此次芬兰科研人员的研究结论为“遗传基因”决定说又增加了新的证据。
研究团队调取了芬兰的大型健康和生活方式研究数据库里的相关信息。数据库记录了6000名参与者的基因构成和肠道微生物状况,并收集了有关他们的饮食、生活方式、处方药使用信息等。
研究人员对数据进行了梳理,寻找一个人的饮食和遗传如何影响肠道微生物组的线索。研究团队发现,人类基因组的两个点位似乎强烈影响肠道中存在哪些微生物:一种含有消化乳糖的基因,另一种则有助于确定血型。而在此前,2月初发表在《自然·遗传学》上的一项研究通过分析荷兰7700人的基因组和肠道微生物之间的关系,也显示了相同的基因位点。
王立娜表示,不管饮食和基因哪个对肠道菌群的影响力更强大,目前仍然需要更深入地了解宿主—微生物组之间复杂的相互作用。
“肠脑轴”连接肠道与大脑
在此项研究中,研究团队还发现,两种导致住院患者感染的常见细菌——摩根氏菌和Kiebdiella菌在肠道中的大量存在似乎能引起抑郁。研究团队对181名后来患上抑郁症的人进行了一项微生物调查,发现他们肠道中的摩根氏菌显著增加。
此项研究在某种细菌水平的升高与抑郁症之间建立了联系,似乎“进一步证明”肠道微生物引起的炎症会影响人的情绪。
对此王立娜介绍,近年来,微生物—肠—脑轴(MGB)概念的提出,突破了脑疾病“脑内分子”异常学说的限制,根据肠道微生物可检测、易修饰特性,开发早诊断、早治疗等手段,使脑病肠治成为可能。
重庆医科大学附属第一医院郑鹏教授聚焦微生物—肠—脑轴,探索了抑郁症的潜在机制。相关研究显示,缺乏肠道微生物的无菌小鼠表现运动增加,焦虑行为减少,5-羟色胺(5-HT)等神经递质升高,影响突触可塑性相关基因,社会交互受损,且具有性别特异性。
来自爱尔兰科克大学APC微生物组的研究人员针对抑郁症病因、发生发展和治疗的研究发现,肠道菌群不仅控制我们的食物偏好,它还可以控制我们的心情。“该项研究发现,肠道菌群主要通过改变我们的味觉受体、产生改变情绪的毒素和劫持我们的迷走神经控制我们的饮食行为;通过分泌神经递质血清素和多巴胺让我们开心,通过影响免疫系统促使机体分泌炎症因子使我们情绪低落。”王立娜介绍。
肠道菌群与精神病相关的例子不少见。不久前,《精神病学前沿》报道,两个抑郁症患者的病情通过粪菌移植得到缓解 。国内一个多中心合作研究,基于311位患者和健康对照,发现了与抑郁症相关联的肠道细菌物种、代谢通路和代谢物。
了解肠道菌群与精神类疾病的关系,是否可以反过来通过调节肠道菌群治疗精神类疾病?
“的确有科研人员进行过类似的研究。”王立娜介绍,2019年上海交通大学医学院附属上海市精神卫生中心陈京红博士团队就带来了一项有意思的研究,发现通过饮食控制等干预调节肠道菌群,可能有助于缓解焦虑。
王立娜最后表示,目前肠道菌群与“肠脑轴”的研究还处在萌芽阶段,抑郁症有多种表现型,细菌也可以通过许多种方式与精神障碍产生关联。此项研究虽然取得了一些突破,但是尚不清楚是否能通过减少或者杀灭肠道中摩根氏菌来缓解抑郁症。这将是个更大的挑战。
【来源:科技日报】

上海中乔新舟生物科技有限公司
1、原代细胞:人脐静脉内皮细胞、人脐带间充质干细胞、人脂肪间充质干细胞、iPS诱导多能干细胞(可提供细胞流式及免疫荧光鉴定报告,需签订MTA协议)。
2、培养基:原代细胞专用低血清、无血清、无异源蛋白无动物成分培养基。
3、细胞培养试剂:胎牛血清、原代细胞转染试剂盒、细胞实验检测试剂盒、细胞生长因子、ELISA试剂盒、定量PCR芯片试剂盒、DNA/RNA及细胞裂解物等。
4、细胞系(株):种类丰富,已通过STR鉴定;提供细胞株完全培养基。
5、自研产品:支原体检测/清除试剂盒、端粒酶检测试剂盒、人源/动物源ELISA试剂盒等系列产品。
6、技术服务:细胞荧光标记服务(GFP/RFP/LUC)、干扰/过表达稳转株构建、细胞基因敲除、细胞系鉴定服务(STR)、原代细胞永生化、肿瘤细胞耐药株构建、原代细胞分离等。

