免疫沉淀(IP)裂解液和试剂
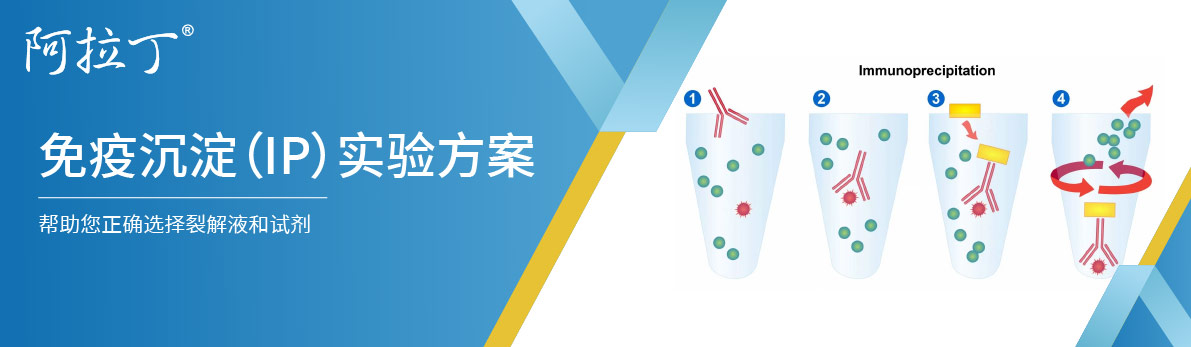
免疫沉淀是一种能够纯化蛋白质的方法。将目标蛋白质的抗体与细胞提取物一起孵育,抗体会与溶液中的蛋白质结合。通过使用蛋白A/G偶联的琼脂糖珠将抗体/抗原复合物从样品中提取出来 。这可以将目标蛋白质与样品的其余部分分离。然后通过SDS-PAGE分离样品进行蛋白质印迹分析。
裂解缓冲液
理想的裂解缓冲液将最大限度地减少蛋白质变性,同时从样品中释放足够量的蛋白质。NP-40和Triton X-100等非离子型去污剂的刺激性低于SDS和脱氧胆酸钠等离子型去污剂。其他可能影响免疫沉淀成功的变量包括了盐浓度、二价阳离子浓度和pH值等。为了优化变量,应在以下范围内测试它们:
-盐:0-1 M
-非离子洗涤剂:0.1-2%
-离子洗涤剂:0.01-0.5%
-二价阳离子:0-10 mM
-EDTA:0-5 mM
-酸碱度:6-9
非变性裂解缓冲液
用于可溶于去污剂且可被抗体以天然形式识别的抗原。Triton X-100可以替代NP-40。
-20 mM Tris HCl pH 8
-137 mM 氯化钠
-1% Nonidet P-40 (NP-40)
-2 mM EDTA
4°C下最多可保存6个月,使用前立即添加蛋白酶抑制剂。
为方便起见可配制10%脱氧胆酸钠储备液(5g加入50mL),必须避光。
不含去垢剂的可溶性蛋白裂解缓冲液
一些可溶性蛋白质可能不需要使用洗涤剂。此缓冲液用于机械细胞裂解,例如使用杜恩斯匀浆器进行匀浆。
PBS含有:
-5mM EDTA
-0.02%叠氮化钠
4°C下最多可保存6个月,使用前立即添加蛋白酶抑制剂。
非去污剂可溶性抗原的变性裂解缓冲液
仅识别变性蛋白质的抗体无法接近天然蛋白质的表位。收获和裂解细胞时,在变性裂解缓冲液中加热细胞。该方法也可用于无法用非离子去污剂从细胞中提取的抗原。使用蛋白酶抑制剂将有助于从染色质中提取蛋白质。
1% SDS
5mM EDTA
室温下最多可保存1周。
使用前立即添加
蛋白酶抑制剂15 U/mL
洗涤缓冲液
-10mM Tris;调节pH至7.4
-1mM EDTA
-1mM EGTA;pH8.0
-150mM氯化钠
-1% Triton X-100
-0.2mM原钒酸钠
4°C下最多可保存6个月。使用前立即添加蛋白酶抑制剂。
其他试剂
蛋白酶抑制剂
细胞裂解后,蛋白水解、去磷酸化和变性过程就开始了。将样品放在冰上会减慢这些过程,但也可以使用蛋白酶和磷酸酶抑制剂混合物。如果不使用混合物,PMSF(50 μg/mL)和抑肽酶(1 μg/mL)是常用于免疫沉淀的蛋白酶抑制剂。
其他试剂
-无菌PBS pH 7.4
-无菌PBS-BSA 1% w/v(过滤)
-TBST缓冲液
-用于蛋白质印迹的上样/样品缓冲液
-VeriBlot用于免疫沉淀二抗,在蛋白质印迹过程中优先检测未还原、未变性 的一抗。
-100mM EDTA库存溶液由1.86gEDTA溶解在40mL H2O中制成。添加NaOH 将pH调节至7.4。最后将总体积调整至50 mL。
制备裂解物
细胞培养物裂解物(非变性)
1,将细胞培养皿置于冰上,并用冰冷的PBS清洗细胞。
2,排干PBS,然后添加冰冷的裂解缓冲液(1mL每107个细胞/100mm2培养皿 /150cm2烧瓶;0.5 mL每5×106个细胞/60mm2培养皿或75cm2烧瓶)。
3,使用冷塑料细胞刮刀将贴壁细胞从培养皿上刮下,然后将细胞悬浮液轻轻转 移至预冷的微量离心管中。
4,在4°C下保持恒定搅拌30分钟。
5,在4°C的微量离心机中离心。
您可能需要根据细胞类型改变离心力和时间。原则是12,000 rpm,20分钟, 但您应该针对您的特定实验进行优化(例如,白细胞需要非常轻微的离心)。
6,轻轻地从离心机中取出管子并置于冰上。吸出上清液并置于冰上的新管中, 并丢弃沉淀。
细胞培养物裂解物(变性)
1,将100μL变性裂解缓冲液添加到0.5-2×107个细胞中。
2,以最大速度剧烈涡旋2-3秒充分混合。将细胞悬液转移至微量离心管中。由 于DNA的释放,溶液在此阶段可能会变得粘稠。
3,将样品加热至95°C,5分钟使其变性。
4,用0.9 mL非变性裂解缓冲液稀释悬浮液,轻轻混合。
非变性裂解缓冲液中过量1% Triton X-100会淬灭原始变性缓冲液中的SDS。
5,将裂解的悬浮液通过连接到1 mL注射器的针头5-10次,从而打碎DNA。
通过重复机械破坏,直到粘度降低。如果 DNA存在未完全消化和片段化, 可能会干扰离心后沉淀与上清液的分离。
6,在冰上孵育5分钟。
7,继续进行免疫沉淀。
组织裂解物
1,用干净的工具尽快解剖组织。如果可能,请在冰上进行以防止蛋白酶降解。
2,将组织放入圆底微量离心管中,浸入液氮中快速冷冻。将样品储存在-80°C 下供以后使用或保存在冰上以便立即均质化。
3,对于约5 mg的组织片,将约300 μL裂解缓冲液快速添加到管中,并用电动 匀浆器匀浆。
4,每次冲洗时用另外300 μL裂解缓冲液冲洗刀片两次,然后在4°C下保持恒 定搅拌2小时(例如置于冰箱中的定轨摇床上)。
裂解缓冲液的体积必须根据存在的组织量来确定。蛋白质提取物不应太稀,以避免蛋白质损失并尽量减少上样到凝胶上的样品体积。最低浓度0.1mg/mL;最佳浓度为1–5mg/mL。
如果需要变性样品,使用变性裂解缓冲液并执行上述变性方案中的步骤2-5。
5,在微量离心机中于4°C下以12,000 rpm离心20分钟。轻轻地将管从离心机 中取出并置于冰上,吸出上清液并置于冰上保存的新管中丢弃沉淀。
预清除裂解物
预清除裂解物有助于减少非特异性结合并降低背景。但如果蛋白质的最终检测是通过蛋白质印迹法进行,则不需要预清除,除非污染蛋白质干扰了目标蛋白质的可视化。
1,将50 μL与免疫沉淀抗体相同种类和同种型的脱靶抗体或正常血清(通常首 选兔)添加到1 mL裂解液中。在冰上孵育1小时。
2,将100 μL珠浆添加到裂解液中。
3,在 4°C下孵育10–30分钟,并轻轻搅拌。
4,在微量离心机中于4°C以14,000 g旋转10分钟。
5,丢弃珠粒并保留上清液用于免疫沉淀。
为了提高产量,可以在裂解缓冲液中将珠子洗涤1或2次以上,并将上清液 收集在一起。
重要的是要确保尽可能多地去除正常血清。为了确保这一点,可以使用裂解缓冲液代替样品进行测试,并执行上述所有预清除步骤。
将所得上清液进行凝胶电泳并用考马斯染色显示血清Ig是否被有效去除。如果血清未充分去除,重链和轻链将出现50和25kDa的条带;它的存在可能会导致免疫沉淀反应较弱。考虑减少血清量或增加预澄清步骤中与样品一起孵育的珠子量。
参考文献
1.Bonifacino, Juan S. et al. Current Protocols in Immunology 8.3.1 -8.3.28, New York: John Wiley, 2001.
2.Harlow, Ed, and David Lane. Using Antibodies. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press, 1999.
