化疗耐药是许多结直肠癌患者预后不良重要原因之一,许多研究表明肿瘤微环境和细胞自噬都与肿瘤化疗耐药密切相关。IL-6作为肿瘤微环境中一种常见的细胞因子,在肿瘤血管生成、侵袭转移、免疫逃逸等生物学行为中发挥显著作用,也有研究报道其参与了肿瘤化疗耐药的调控,但内在分子机制仅集中在IL-6/STAT3这一经典信号。
2021年6月15日,华中科技大学王桂华教授及胡俊波教授共同通讯在《Nature Communications 》(2020 IF: 14.919)上在线发表了题“ IL-6 regulates autophagy and chemotherapy resistance by promoting BECN1 phosphorylation” 的研究论文。该研究发现并证明了IL-6调节细胞自噬和肿瘤化疗耐药的新机制,并阐述了该机制的潜在临床应用价值。

研究思路及方法
一、IL-6通过非依赖于STAT3通路诱导细胞自噬
通过western blot、免疫荧光、电镜等实验技术,作者发现予以IL-6刺激后细胞自噬水平明显上升。同时利用STAT3磷酸化抑制剂以及STAT3表达缺失细胞研究发现,IL6诱导的细胞自噬并不依赖于STAT3。
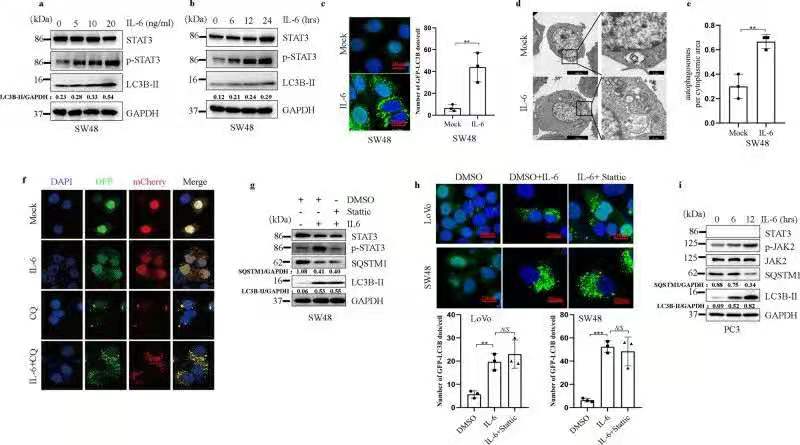
二、IL-6以JAK2信号依赖的方式促进细胞自噬
由于JAK2在IL-6下游信号传导中起重要作用,作者通过使用JAK2小分子抑制剂以及沉默JAK2的表达,研究发现IL-6以JAK2信号依赖的方式诱导自噬。
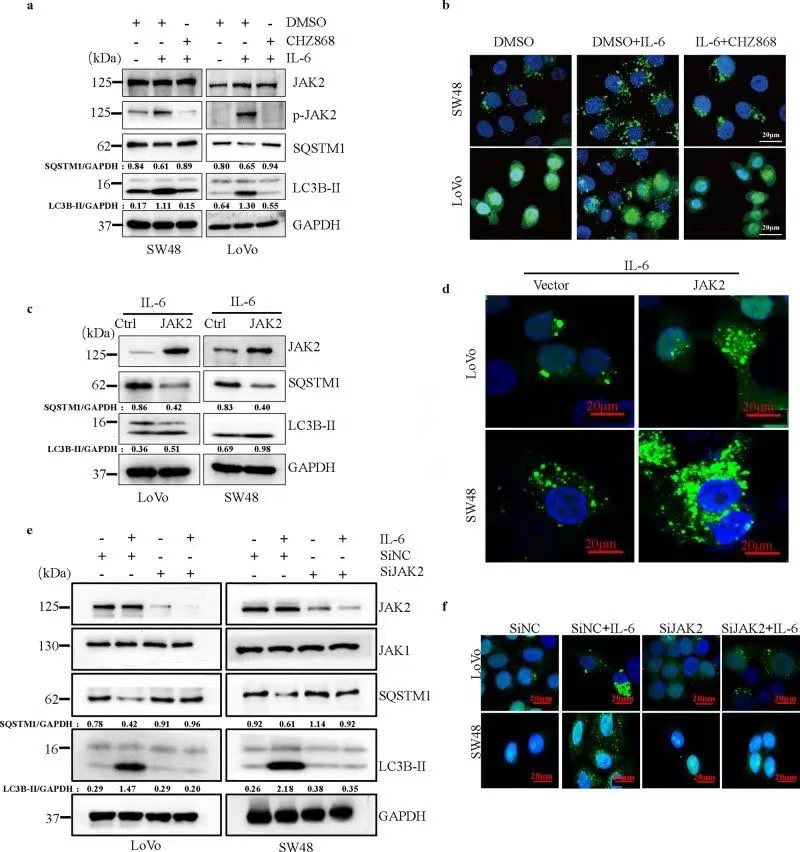
三、JAK2能够与BECN1结合并且使其Y333发生磷酸化
进一步通过生物信息学技术、免疫共沉淀、免疫荧光等实验技术,发现JAK2能够和BECN1结合。因为JAK2作为一种已知的酪氨酸激酶,作者猜想BECN1可能是JAK2的磷酸化底物。通过western blot实验发现JAK2能够影响BENC1的磷酸化水平,并利用数据库分析、蛋白质结构分析预测其被磷酸化的位点,最后证明BECN1 Y333位点被JAK2磷酸化。重要的是,JAK2敲低显著地消除了IL-6刺激引起的BECN1 Y333磷酸化水平的升高。
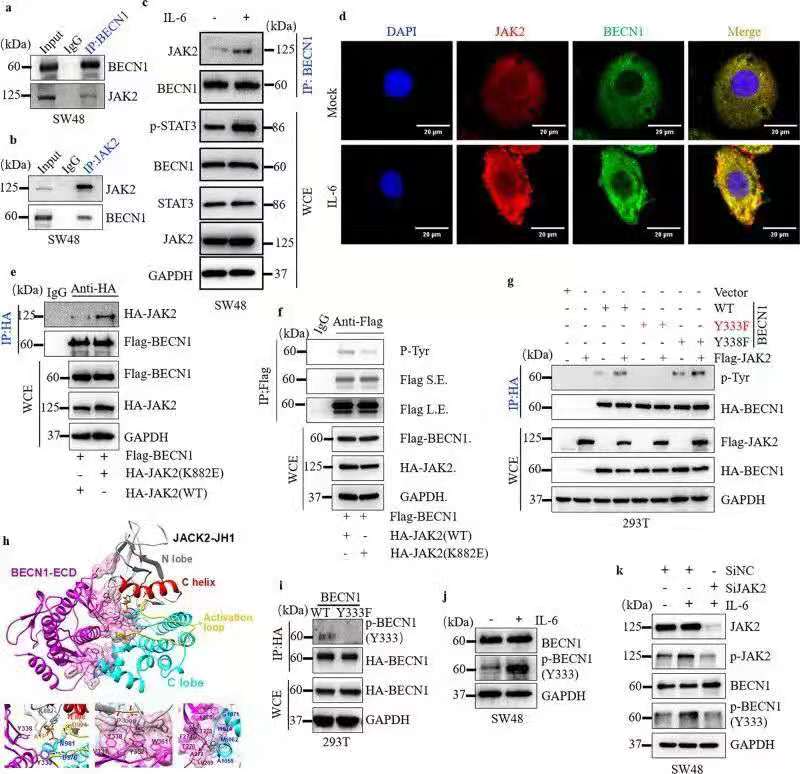
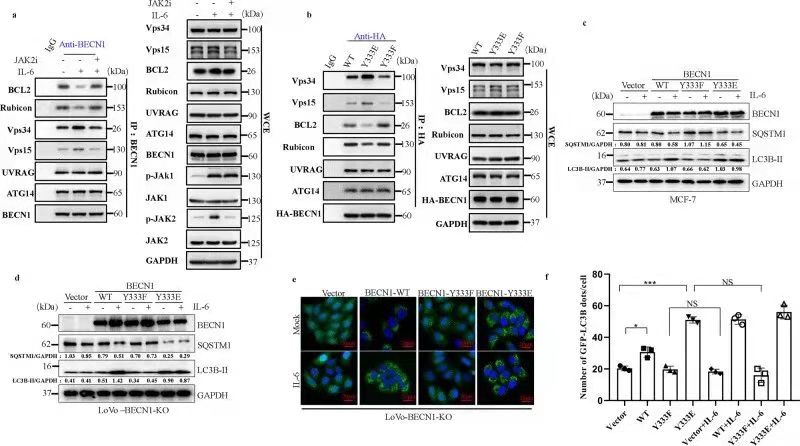
四、BECN1 Y333磷酸化是IL-6诱导的自噬所必需的
利用免疫共沉淀、免疫荧光等实验技术,作者更深入的探讨了BECN1 Y333磷酸化在IL-6诱导细胞自噬中的作用。研究发现IL-6诱导JAK2介导的BECN1磷酸化,影响了BECN1与Vps34、Vps15、BCL2、Rubicon之间的结合,进而促进细胞自噬。
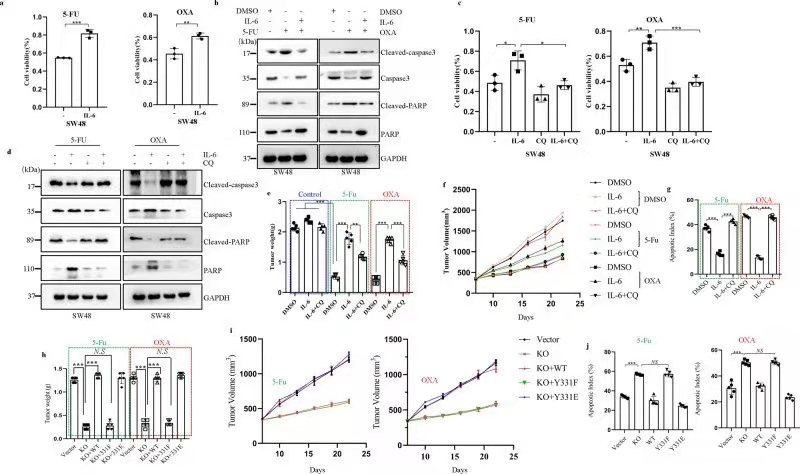
五、IL-6诱导的BECN1 Y333磷酸化促进肿瘤化疗耐药
通过细胞活力检测、细胞凋亡检测等实验技术,作者发现IL-6刺激可显著消除奥沙利铂(OXA)和5-氟尿嘧啶(5-Fu)引起的细胞活力下降,但这一作用被氯喹所逆转。这一结果在动物实验中同样得到证实。为验证BECN1 Y333磷酸化在IL6诱导肿瘤化疗耐药中的作用,作者利用吉凯基因的慢病毒产品构建了BECN1敲除的CT26细胞系,并在此基础上构建了CT26-WT、CT26-Y331F和CT26-Y331E细胞株进行动物实验,研究发现CT26-WT、CT26-Y331E细胞株的皮下瘤生长更加明显。
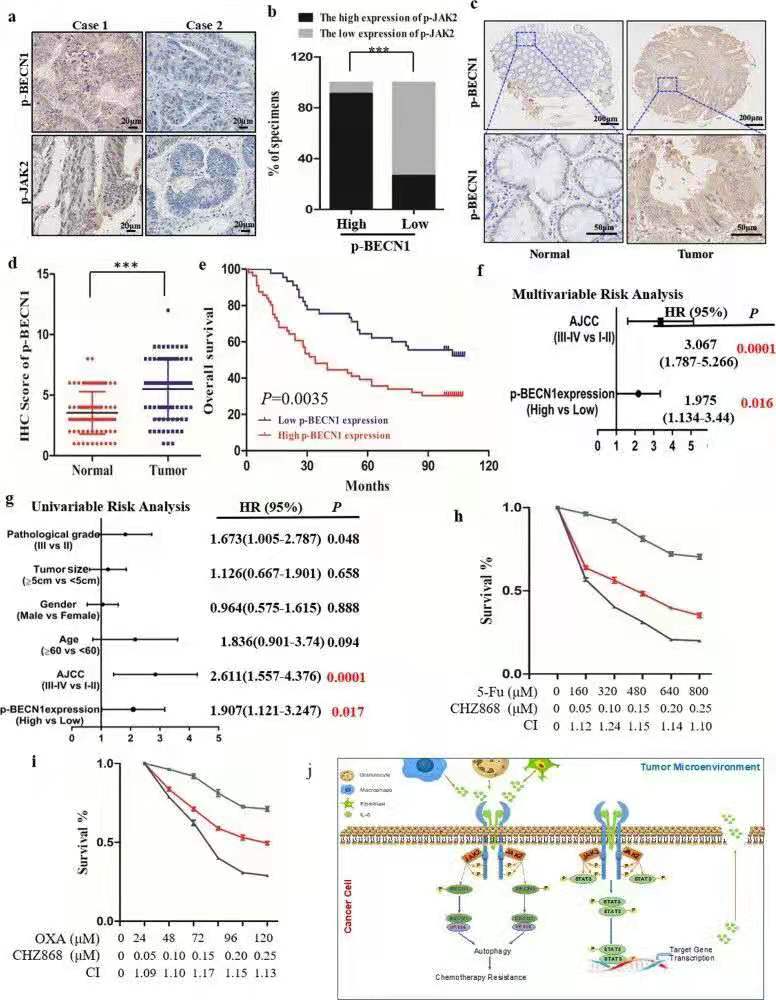
六、JAK2诱导的BECN1 Y333磷酸化是肿瘤预后差和化疗耐药的预测标志物
作者通过对肿瘤组织芯片进行免疫组化检测并进行统计分析,发现BECN1 Y333磷酸化可以结肠癌预后的潜在标志,同时联合IL-6/JAK2/BECN1信号通路靶点药物可协同传统化疗药物对肿瘤细胞的杀伤作用。
研究总结
1. 阐明了细胞外细胞因子与自噬之间的调控信号通路(IL-6/JAK2/ BECN1信号通路),并表明JAK2依赖的BECN1磷酸化可能与化疗耐药有关。
2. IL-6诱导的自噬有助于提高结直肠癌化疗药物反应的有效性,联合靶向IL-6/ JAK2/BECN1信号通路的自噬抑制剂或药物可能是一种潜在的临床治疗策略。
3. BECN1 Y333磷酸化可作为结直肠癌不良预后的预测标志物,并可作为结直肠癌化疗潜在效益的标志物和早期诊断化疗耐药性的标志物。
吉凯助力

该研究中使用的小鼠BECN1基因敲除慢病毒由吉凯基因提供,助力实现高效特异的基因敲除。
作者简介
华中科技大学同济医学院附属同济医院王桂华教授和胡俊波教授为论文共同通讯作者,住院医师胡福清和宋达为论文第一作者。该研究得到国家自然基金面上项目资助。

病毒实验帮
公众号底部菜单栏【新功能】上线!
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
