脑中可溶性淀粉样β肽(AβOs)的积聚已被认为与阿尔茨海默病中的突触衰竭和记忆损害有关。在这项研究中,研究者使用NUsc1进行治疗,这是一种选择性靶向AβOs的单链变量片段抗体(scFv),能够预防小鼠海马切片中长时程增强的抑制和AβOs引起的记忆损害。
里约热内卢州联邦大学医学生物化学研究所的研究者们,开发了一种腺相关病毒载体AAV-NUsc1,用于在大脑内驱动NUsc1的神经元表达。AAV-NUsc1在成年人脑切片中诱导NUsc1的表达和分泌,并且抑制了AβOs与神经元的结合,以及AβOs诱导的大鼠海马原代培养中树突棘丧失。用AAV-NUsc1治疗小鼠阻止了AβOs引起的记忆损害,并且更重要的是逆转了APPswe/PS1ΔE9老年阿尔茨海默病模型小鼠的记忆缺陷。研究成果以“AAV-mediated neuronal expression of a scFv antibody selective for Aβ oligomers protects synapses and rescues memory in Alzheimer models”为题,发表在Moleculat Therapy(IF:12.91)上。

研究结果
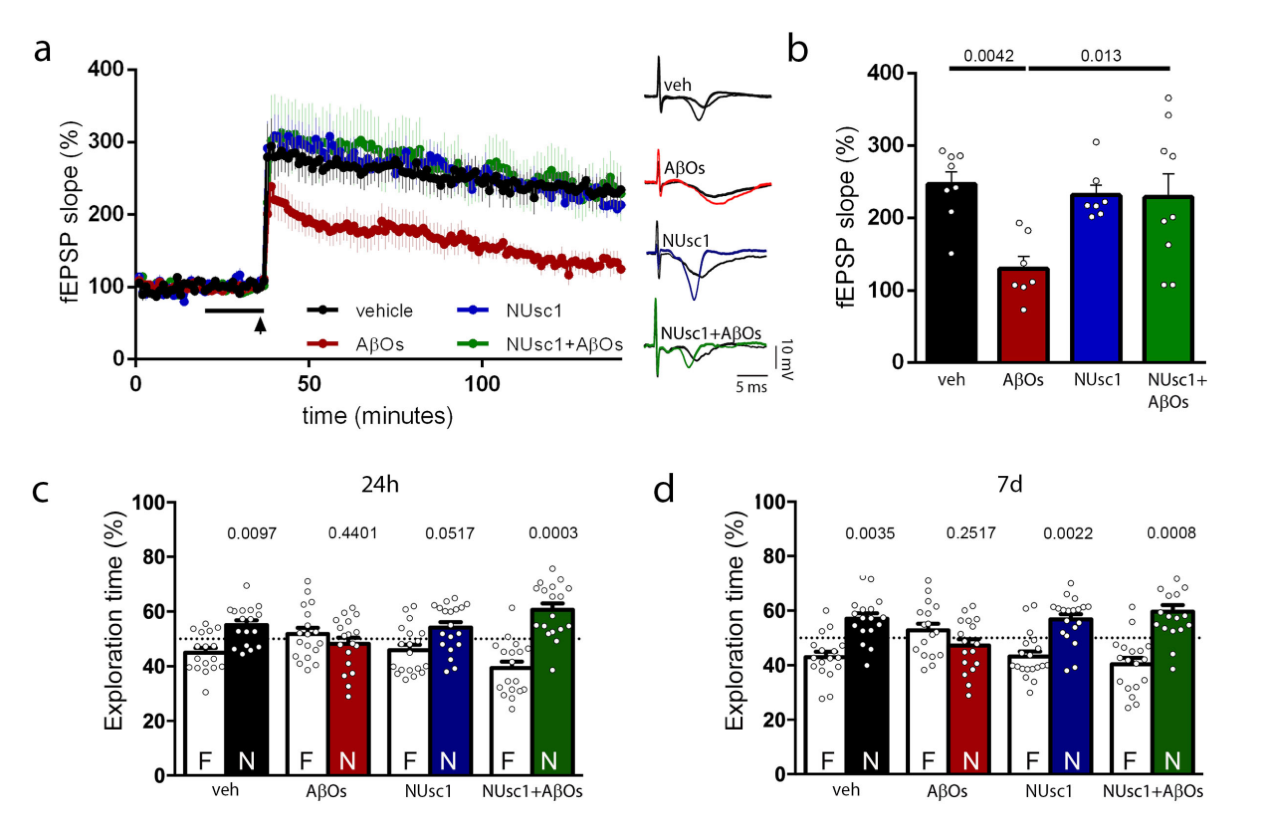
1.NUsc1能够预防AβOs引起的海马长时程增强和记忆方面的损害。
首先,研究者们测试了外源性重组NUsc1是否可以阻断AβOs引起的海马长时程增强(LTP)的抑制和记忆损失。将小鼠海马切片暴露于200nM的AβOs,并测量Schaeffer collaterals高频刺激引起的LTP反应。与之前的研究一致,暴露于AβOs的海马切片LTP受到抑制。相反,在应用AβOs之前用NUsc1处理的切片表现出正常的LTP。对照测量显示NUsc1对控制组海马切片的LTP没有影响(即在没有AβOs的情况下)。为了确定NUsc1是否可以预防AβOs引起的记忆损害,在小鼠的脑室内注射(i.c.v.)注入NUsc1,然后在注射AβOs前30分钟进行i.c.v.给药,使用新物体识别(NOR)测试评估它们的记忆。与先前的研究一致,注射AβOs的小鼠在注射AβOs后的24小时和7天都表现出记忆损害。相反,NUsc1处理的小鼠在注射AβOs后的24小时和7天都表现出正常的NOR测试结果。
2. AAV-NUsc1的构建
接下来,研究者试图确定AAV介导的NUsc1转导和神经元表达是否对AD模型具有保护作用。构建了一个AAV9载体,其中携带NUsc1的核苷酸序列(经过单个氨基酸替换以在真核生物中表达),位于信号肽(SP)的下游,用于分泌途径的导出,并由选择性神经元表达的synapsin I启动子控制。通过选择性靶向神经元并使用3x109个AAV-NUsc1的单剂量,旨在防止NUsc1在大脑中过度表达,从而大程度地减少可能导致抗体自聚集的浓度依赖性和异常免疫或炎症反应的潜力。

3. AAV-NUsc1在人类成人皮质切片中诱导表达NUsc1的神经元
为了检验AAV-NUsc1在AD中的转化潜力,研究者们首先测试了AAV-NUsc1在成年人脑组织中驱动scFv抗体产生和分泌的能力。通过使用AAV9-mCherry对照载体进行初步测试,确认了成年人皮层切片培养中的蛋白表达。将成年人皮层切片暴露于不断增加的AAV-NUsc1滴度中,显示出NUsc1的剂量依赖性表达。通过点状免疫印迹分析确认了NUsc1蛋白的表达和分泌到培养基中。结果表明,AAV-NUsc1能转导成年人神经元并驱动NUsc1的表达和分泌。
4. AAV-NUsc1减少AβOs与神经元的结合,并预防AβOs引起的树突棘丧失
为了确定AAV-NUsc1是否能保护神经元免受AβOs的毒性影响,研究者们首先对成熟的海马体外培养14天,并进行AAV-NUsc1的转导。由于已有报道显示重组NUsc1可以阻止AβOs与神经元的结合,研究者们想知道由AAV-NUsc1转导的神经元产生和分泌的NUsc1是否也能类似地阻止AβOs与神经元的结合。试验结果显示,AAV-NUsc1的转导导致海马神经元树突中AβOs结合减少了约50%。
接着研究者们进一步研究了AβOs结合减少是否可以保护神经元免受AβOs引起的树突棘丧失。暴露于AβOs的神经元显示出较对照组文化减少的树突棘密度,而在暴露于AβOs之前通过AAV-NUsc1转导的神经元表现出正常的树突棘密度。
5. AAV-NUsc1在小鼠AD模型中恢复了记忆。
作为在评估AAV-NUsc1在体内起效之前的对照实验,研究者们检查了在小鼠中i.c.v.注射AAV9-mCherry对照载体后mCherry转基因的大脑分布和神经元表达情况。结果显示,AAV-mCherry诱导了mCherry在整个小鼠大脑的表达,8周后在海马和纹状体表达明显。
在确认了i.c.v.注射的AAV9载体成功转导AD相关脑区的神经元后,接下来在小鼠中i.c.v.注射了AAV-NUsc1,并通过qPCR和免疫印迹验证了NUsc1在他们的大脑中的表达情况。
在i.c.v.注射AAV-NUsc1或用作对照的AAV-mCherry(对照组)2个月后,动物接受了i.c.v.注射AβOs。在进行新物体识别(NOR)记忆测试时,注射AβOs的小鼠和注射AAV-mCherry后注射AβOs的小鼠均未能完成任务。相比之下,接受AAV-NUsc1转导并注射AβOs的小鼠在NOR任务中表现正常。对照实验显示,AAV-NUsc1转导对对照组注射车载体的小鼠在NOR测试中没有影响。
最后,测试了AAV-NUsc1对老年APPswe/PS1ΔE9 AD模型小鼠的记忆损害的有益作用。在i.c.v.注射AAV-NUsc1后两个月,对APPswe/PS1ΔE9小鼠(或野生型同胞)进行记忆测试。通过ELISA评估了WT和APP/PS1小鼠的NUsc1脑内水平。APPswe/PS1ΔE9小鼠在NOR测试和三箱社会交互实验的社交记忆阶段中都未能完成任务,但在三室测试的社交性阶段中表现正常。结果显示,接受AAV-NUsc1转导的APPswe/PS1ΔE9小鼠在NOR和社交记忆任务中表现正常,表明记忆损害得到逆转。

研究总结
这篇文章主要介绍了一种治疗阿尔茨海默病的潜在方法,使用AAV介导的神经元表达一种选择性靶向Aβ寡聚体的scFv抗体,该方法可以保护突触并在阿尔茨海默病模型中恢复记忆。研究人员使用NUsc1作为scFv抗体,并通过AAV9载体在大脑内实现了NUsc1的神经元表达。他们在实验中观察到,AAV-NUsc1转导能降低AβOs与神经元的结合,保护神经元免受AβOs的毒性影响,并预防AβOs引起的树突棘丧失。在小鼠模型中,通过AAV-NUsc1治疗可预防AβOs引起的记忆损害,并且能逆转老年阿尔茨海默病模型小鼠的记忆缺陷。这些结果表明,AAV介导的scFv抗体在治疗阿尔茨海默病中具有潜在疗效,并为基因介导免疫治疗提供了一个有希望的治疗策略

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
