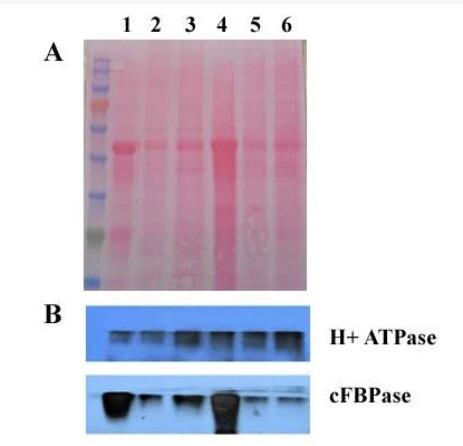
描述:有大量证据表明,在动物和植物膜系统中都存在抗去污剂膜(DRM)的亚结构域,即脂筏。脂筏增加了鞘脂蛋白的比例和胆固醇浓度。脂筏在真核细胞的信号转导和蛋白质转运中起着重要作用。传统分离脂筏的方法包括冷的非离子去污剂提取,然后使用蔗糖梯度超速离心,这种方法需要大量的起始样品(数百克),并且除了耗时的操作外,还需要专用设备。为此我们开发了这种从植物组织中快速分离提取脂筏的方法,仅需毫克级的起始样品,无需超高速离心,约1小时即可完成脂筏的分离。
应用:试剂盒用于快速从植物组织中富集天然脂筏,可应用于 SDS-PAGE,immunoblottings,ELISA,IP,膜蛋白质结构分析,2-D,酶活性测定及其他应用。
储存温度:4℃
试剂盒组分: 1. 缓冲液 A 10ml 2. 缓冲液 B 10ml 3. 缓冲液 C 1.2ml 4. 缓冲液 D 10ml 5. 塑料研磨棒 2 根 6. 蛋白提取粉 2g 7. 离心管柱/收集管 20 套 运输储存:常温运输,4 度保存
重要产品信息:
1. 操作前请仔细阅读整个操作说明。缓冲液 A,B,C 使用前放置于冰上预冷。
2. 离心机请调整成 RCF 模式(xg),所有离心步骤都需要在 4℃室温下或者低温离心机中进行。
3. 研究蛋白磷酸化,磷酸酶白酶抑制剂应在使用前加入缓冲液 A 中。(请按照蛋白酶或磷酸酶抑制剂母液比例添加,例如母液是 100x,添加时按照 1:100 添加,即 1ml 缓冲液 A 添加 10ul 抑制剂)。
4. 需准备预冷的 ddH2O。
5. 请勿使用液氮研磨,研磨方式请按说明书进行。
操作方法:
1. 将 200-250mg 新鲜植物叶片或幼苗加到离心管柱中,将叶片折叠卷起塞入到离心管柱套管中。加入 100ul缓冲液 A,用 200ul 吸头按压叶片 80-100 次以压缩叶片体积(此步大概需要 1-2min)。加 50-80mg 蛋白提取粉到离心管柱中。
2. 用试剂盒中研磨棒用力向下扭转按压研磨 200 次(大约 2-3min)。(注意:研磨棒可重复使用,用 70%酒精擦拭或用蒸馏水冲洗干净,用纸巾擦干。)
3. 再加 400ul 缓冲液 A 到离心柱中,用 200ul 吸头将样品搅拌混匀。盖上盖子,8000Xg 离心 10min。这一步可以去除叶绿体,细胞核和一些大碎片。离心后,弃去离心柱,将上清转移到一个新的 1.5ml 离心管中。
4. 16000Xg,离心 30min,弃去上清。小心的加入 1ml 预冷的 ddH2O 清洗沉淀,不要打散沉淀,将水立即弃 掉。
5. 加入 450ul 缓冲液 B 吹打沉淀重悬,再向管中加入 50ul 缓冲液 C,混匀后放于冰上孵育 30min。孵育完成后,大力涡旋震荡 20s,10000Xg,离心 5min。离心后将上清转移至新的 1.5ml 离心管中。
6. 加入 500ul 缓冲液 D,简单振荡混匀,冰上孵育 10min。孵育完成后 10000Xg,离心 5min。离心后,脂筏
会漂浮在管子最上层。
7. 用移液器配上细的吸头(如 SDS-PAGE 上样吸头)插到管底,缓慢地完全去除水相。或者也可以使用配 有 21 号针头的 2 毫升注射器。去除水相后(非脂筏的膜蛋白保留在这个水相中,如有兴趣可保留),浅绿
白色的脂筏会附着在离心管壁上。
8. 将离心管 16000Xg,离心 5min,将脂筏离心到管底部,完全去除残液。小心的加入 200μl 预冷的 ddH2O清洗沉淀,不要打散沉淀,并将水快速弃掉。得到的沉淀即是分离的脂筏组分,脂筏沉淀可以根据下游应用选择适合的溶解液进行溶解。蛋白溶解液可根据下表进行选择。根据样品类型不同,最终蛋白质产量在50-100 ug/样品范围内。
技术要点:
1. 用于 2D 凝胶等应用分析时,分离的脂质筏可能需要透析以降低盐浓度。
2. 第 7 步上清液中的非脂筏蛋白可以用蛋白质沉淀试剂盒沉淀。
3. 分离的脂筏主要来自质膜和其他内膜系统。
4. 可以使用传统的有机萃取方法从分离的脂筏中进一步提取脂质。
