本文向您展示了八臂迷宫的技术细节,该迷宫通常与动物运动轨迹跟踪系统(EthoVision XT)结合使用,用于测量两种记忆形式,即"参照记忆"和"工作记忆"。
八臂迷宫是如何工作的?
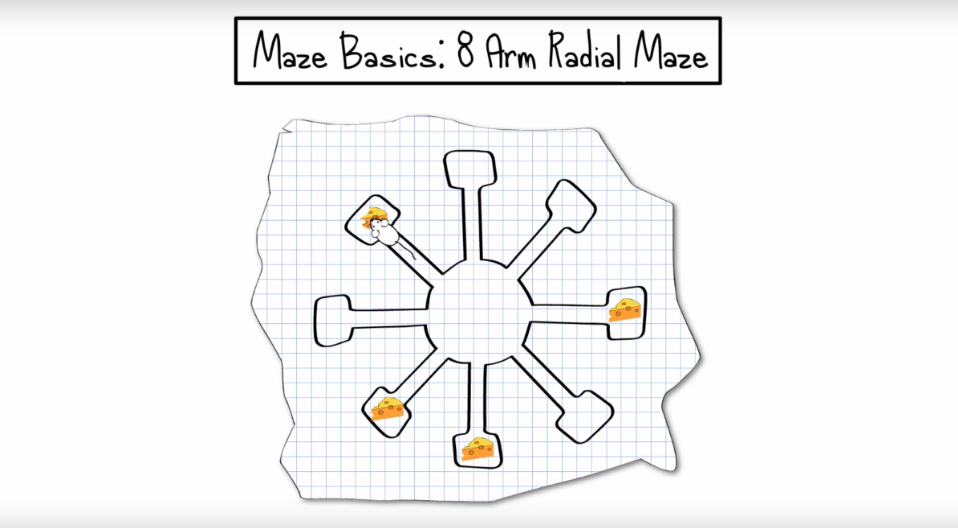
将啮齿类动物(小鼠或大鼠)放置在中心隔间中,让它们探索各个臂以寻找食物奖励。在整个实验过程中,动物们必须记住去过哪些臂区,以确保它们不会重复进入没有食物奖励的臂区。
迷宫的设计确保动物必须在每次探臂之后返回中心,因此每次都会出现相同的 8 个选项,之后它们必须记住已经做出的选择。通过这种方式,八臂迷宫可以测量两种形式的记忆,即"参照记忆"和"工作记忆"。
八臂迷宫的历史和用法
八臂迷宫最初是由大卫-奥尔顿(David S Olton)博士和罗伯特-萨缪尔森(Robert J Samuelson)博士于1976年设计的[1],用于测试啮齿类动物的参照记忆和工作记忆,以及模拟"序列学习"。
参照记忆&工作记忆
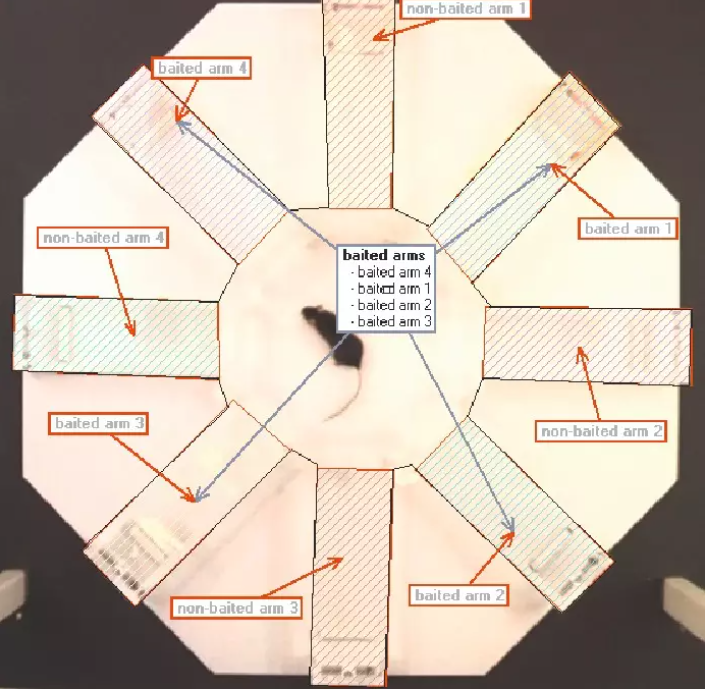
参照记忆是指回忆空间任务中"是什么"和"在哪里"相关信息的能力。因此,在八臂迷宫中,受试者利用参照记忆来记住他们在每个臂中发现了什么(终点有奖励或无奖励)。
工作记忆是用来描述临时存储此类信息的术语。工作记忆是在八臂迷宫等任务中使用的短暂、有限的信息储存。
由于八臂迷宫的测试可以在一次测试中完成,也可以在快速连续进行的多次测试中完成,因此它是对参照记忆和工作记忆的有效测试。
使用八臂迷宫进行各种记忆测试
八臂迷宫已被广泛用于各种情况下的记忆测试,包括精神类药物、药物影响,以及自闭症谱系障碍[2]和脑损伤[3]等疾病。它还被用于描述大脑各记忆功能中心的基本功能以及动物认知能力的个体差异。
基础研究
有趣的是,研究人员注意到不同品系的小鼠在八臂迷宫中的表现存在显著差异。例如,在比较 C57 和 DBA 时,研究人员发现,海马体、杏仁核或额叶皮层对不同品系的依赖程度不同[4]。
测试大脑的特定区域
C57小鼠被认为是"高学习能力"小鼠,它们通常在各种与记忆相关的任务中表现较好。海马区是众所周知的记忆功能区[5],对海马区的损伤会导致 C57 品系或 DBA 品系小鼠的表现出现明显缺陷。然而,杏仁核和额叶皮层的损伤只对 C57 品系小鼠的表现产生有害影响,这表明这些小鼠学习能力的增强可能是由于除了正常的海马活动外,这些脑区也参与了学习。
疾病和治疗
八臂迷宫还被用于研究大量已知会影响记忆的认知功能障碍动物模型(如焦虑症和抑郁症)的行为缺陷。
八臂迷宫实验
例如,研究人员利用一种被称为"先天性无助"(cLH)的抑郁症大鼠模型,发现具有类似抑郁症状的大鼠在这项任务中表现不佳[6]。他们发现,在八臂迷宫中,利用试验之间的短暂延迟,cLH 大鼠在记忆迷宫中哪些臂之前已经去过以及在哪里可以找到食物奖励时,错误率明显更高。这一发现表明,与人类一样,伴随抑郁而来的焦虑状态会干扰记忆功能并抑制决策制定。
药物治疗干预
由于八臂迷宫可作为精神疾病认知缺陷的模型,如上述实验中的模型,因此迷宫也可用于测试改善这些症状的药物治疗。
学者们对以 GABA-A 受体为靶点的药物治疗干预产生了兴趣,而 GABA-A 受体本身在历史上就被证明参与了一系列记忆功能[7]。事实上,GABA-A 受体功能障碍普遍存在于重度抑郁症[8]和精神分裂症[9]中,这些疾病都伴有明显的记忆功能障碍。
治疗记忆障碍
近些年开发的两种抑制GABA-A受体的药物有望治疗以八臂迷宫为模型的记忆障碍。
首先,研究人员利用大鼠模型,通过服用scopolamine或NMDA拮抗剂MK-801诱发精神分裂症状,发现新型药物ONO-8590580能够逆转与这种疾病相关的记忆功能障碍[10]。接受scopolamine或MK-801的小鼠在八臂迷宫中的表现出现了预期的缺陷,这证实了诱导认知障碍模型的有效性。
在服用ONO-8590580后,小鼠能够成功完成任务,其效果与从未服用过诱导精神分裂症样症状和记忆缺陷药物的小鼠相似。这样,研究人员就能利用八臂迷宫来确认这种疾病,并展示这种新型疗法的功能。
在多种条件下提高八臂迷宫中的表现
在两组类似的实验中(这一次是为了模拟与神经退行性认知衰退相关的记忆功能障碍),研究人员表明,其他GABA-A受体功能抑制剂可以在多种条件下改善八臂迷宫的表现。2017 年,研究人员利用scopolamine诱导的神经退行性病变模型,测试了另一种名为 S44819 的新型 GABA-A 受体抑制剂[11]。在诱导小鼠出现神经退行性病变状态后,他们用这种化合物治疗动物,发现它能逆转scopolamine诱导的八臂迷宫障碍。
同样的药物还在氯胺酮诱导的小鼠痴呆样记忆功能障碍模型中进行了测试。与上述实验一样,研究人员发现,氯胺酮会导致小鼠在八臂迷宫中表现不佳,小鼠存在严重的记忆功能障碍,而随后使用 S44819 治疗则会改善这些症状[12]。
因此,八臂迷宫提供了一个极好的工作记忆模型,可用于测试针对多种失调和疾病的治疗策略。
研究结论
八臂迷宫已经使用了40多年,它的应用范围很广,从动物模型记忆功能的基本特征分析,到疾病状态下认知障碍的识别和治疗。迷宫的巧妙设计意味着动物不需要预先训练,并允许进行各种修改,如测试工作记忆持续时间的保持期,减少或增加臂的数量以增加任务的复杂性等[13][14]。
参考文献
1. Olton, D. S., & Samuelson, R. J. (1976). Remembrance of places passed: Spatial memory in rats. Journal of Experimental Psychology: Animal Behavior Processes, 2(2), 97-116.
2. Mandolesi, L., Addona, F., Foti, F., Menghini, D., Petrosini, L., & Vicari, S. (2009). Spatial competences in Williams syndrome: a radial arm maze study. International Journal of Developmental Neuroscience, 27(3), 205–213.
3. Penley, S.C., Gaudet, C.M., Threlkeld, S.W. (2013). Use of an Eight-arm Radial Water Maze to Assess Working and Reference Memory Following Neonatal Brain Injury. Journal of Visualized Experiments, (82), e50940.
4. Rossi-Arnaud, C., & Ammassari-Teule, M. (1994). Radial maze performance in inbred mice: Evidence for strain-dependent neural nets subserving spatial learning abilities. Psychobiology, 22(4), 320–327.
5. Aggleton, J. P., Blindt, H. S., & Rawlins, J. N. P. (1989). The effects of amygdaloid and combined amygdaloid-hippocampal lesions upon object recognition and spatial working memory in the rat. Behavioral Neuroscience, 103, 962–974.
6. Richter, S. H., Zeuch, B., Lankisch, K., Gass, P., Durstewitz, D., & Vollmayr, B. (2013). Where have I been? Where should I go? Spatial working memory on a radial arm maze in a rat model of depression. PloS one, 8(4), e62458.
7. Whissell, P. D., Avramescu, S., Wang, D.-S., & Orser, B. A. (2016). δGABAA Receptors Are Necessary for Synaptic Plasticity in the Hippocampus: Implications for Memory Behavior. Anesthesia and Analgesia, 123(5), 1247–1252.
8. Pehrson, A. L., & Sanchez, C. (2015). Altered γ-aminobutyric acid neurotransmission in major depressive disorder: a critical review of the supporting evidence and the influence of serotonergic antidepressants. Drug design, development and therapy, 9, 603-24.
9. Rudolph, U., & Möhler, H. (2013). GABAA receptor subtypes: Therapeutic potential in Down syndrome, affective disorders, schizophrenia, and autism. Annual review of pharmacology and toxicology, 54, 483-507.
10. Kawaharada, S., Nakanishi, M., Nakanishi, N., Hazama, K., Higashino, M., Yasuhiro, T., Kaneko, S. (2018). ONO-8590580, a Novel GABAAα5 Negative Allosteric Modulator Enhances Long-Term Potentiation and Improves Cognitive Deficits in Preclinical Models. The Journal of Pharmacology and Experimental Therapeutics, 366(1), 58–65.
11. Etherington, L.-A., Mihalik, B., Pálvölgyi, A., Ling, I., Pallagi, K., Kertész, S., Lambert, J. J. (2017). Selective inhibition of extra-synaptic α5-GABAA receptors by S44819, a new therapeutic agent. Neuropharmacology, 125, 353–364.
12. Gacsályi, I., Móricz, K., Gigler, G., Wellmann, J., Nagy, K., Ling, I., Antoni, F. A. (2017). Behavioural pharmacology of the α5-GABAA receptor antagonist S44819: Enhancement and remediation of cognitive performance in preclinical models. Neuropharmacology, 125, 30–38.
13. Lenck-Santini PP, Save E, Poucet B (2001). "Place-cell firing does not depend on the direction of turn in a Y-maze alternation task". Eur J Neurosci. 13(5): 1055–8.
14. Cole, M.R.; Chappell-Stephenson, Robyn (2003). "Exploring the limits of spatial memory using very large mazes". Learning & Behavior. 31 (4): 349–368.
关注诺达思公众号,联系我们获取更多产品信息及学术文章!

