IF=38.3 | NEST细胞小室助力中国科学技术大学发表高质科研论文!

研究成果
治疗性纳米颗粒(NPs)跨越血管进入肿瘤间质空间的过程,即渗出,对于实体肿瘤的治疗至关重要。内皮细胞形成血管的内层,是调节液体、大分子和免疫细胞进入间质空间的主要屏障。NPs可以通过主动跨内皮或被动的跨内皮通道绕过内皮屏障。然而,在大多数病例中,只有一小部分(通常少于5%)的NPs能够到达肿瘤的间质区域。尽管主动跨细胞运输或破坏内皮细胞间的连接可以打开内皮细胞的运输途径,但这些机制仍然不能完全解释为什么NPs不能充分进入肿瘤。这就引出了一个问题,即除了内皮屏障外,该领域是否忽视了其他屏障。
基底膜(BM)包裹着肿瘤血管的内皮细胞和壁细胞,它在维持物理化学和生物完整性方面起着至关重要的作用。基底膜是一种致密的、交联的、片状的细胞外基质,位于内皮层之下。在正常的血管中,BM提供机械支持,并作为分子或细胞选择性过滤进入间质组织的重要屏障。然而,肿瘤性血管基底膜具有明显的结构异常,包括内皮细胞和周细胞松散结合,远离血管壁的广泛延伸,层增厚等。虽然基底膜是至关重要的,但在阻碍NPs进入肿瘤间质方面的作用尚不清楚。虽然有迹象表明肿瘤血管并不像先前预测的那样渗漏,但预期渗漏的不足可能并不一定仅仅来自内皮。在这项最新研究中,研究团队发现肿瘤血管基底膜与肿瘤内皮共同构成了一个强大的屏障,阻止NPs从肿瘤血管中离开。
这项研究证明,在多种肿瘤模型中,超过92%的基底膜覆盖血管,并且基底膜作为一种以前被忽视的生理屏障,阻止纳米颗粒试图进入肿瘤。穿过内皮屏障后,纳米颗粒被阻断在内皮下空间形成血管周围纳米颗粒池。在抗肿瘤纳米药物研究中,这种由基底膜引起的纳米颗粒池现象实际上完全阻止了纳米药物进入肿瘤的通道。
通过采用多步策略,试图将汇集的纳米颗粒从基于基底膜的阻断中直接释放到肿瘤中。通过局部热疗(LHT),证明血管内皮(VE)-钙粘蛋白相互作用被破坏,导致NPs在肿瘤血管周围的周边区域积聚增加。招募的中性粒细胞在浸润过程中打开基底膜屏障,通过一系列可重复的剧烈爆发来释放被困在池中的NPs,从而深入并有效地渗透到肿瘤中。
该研究表明,基底膜代表了一个被忽视但重要的纳米颗粒屏障,值得进一步研究以开发工程化策略在必要时克服或维持这种障碍。
实验使用的NEST产品
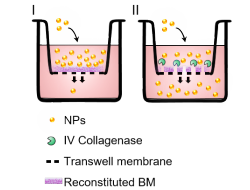
NEST产品:Cell Culture Insert



论文链接
https://doi.org/10.1038/s41565-023-01498-w
