一个基因的表达受多种表达元件调控,有启动子,增强子/沉默子,5’UTR,3’UTR,转录因子,microRNA等,当我们需要验证其具体功能,如启动子的活性,5’UTR和3’UTR是否影响基因的表达,转录因子对启动子是激活还是抑制,microRNA在靶基因3UTR上的结合位点,一段特定序列是否有增强子/沉默子功能时,萤火虫荧光素酶报告基因就是很好的一个用来验证功能的工具。
今天就以pGL3 promoter和pGL3 Basic两个载体来简单说明如何验证这些表达元件的功能,这两个载体都带有萤火虫荧光素酶报告基因,区别是pGL3 promoter在萤火虫荧光素酶报告基因上游有SV40启动子,而pGL3 Basic则只有萤火虫荧光素酶报告基因。请大家一定要注意待研究元件相对于萤火虫荧光素酶基因的位置,位置不同,功能不同。
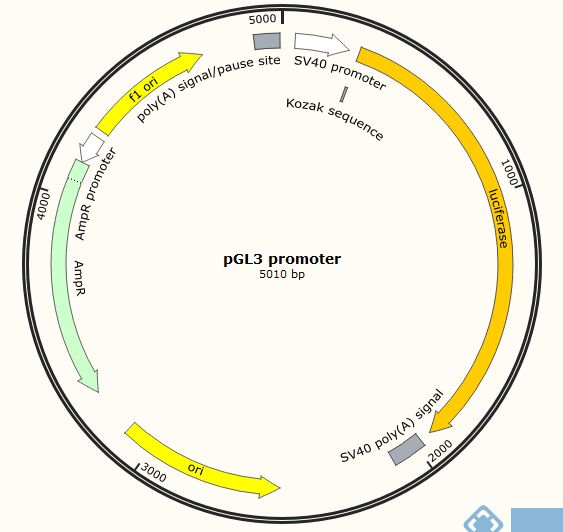
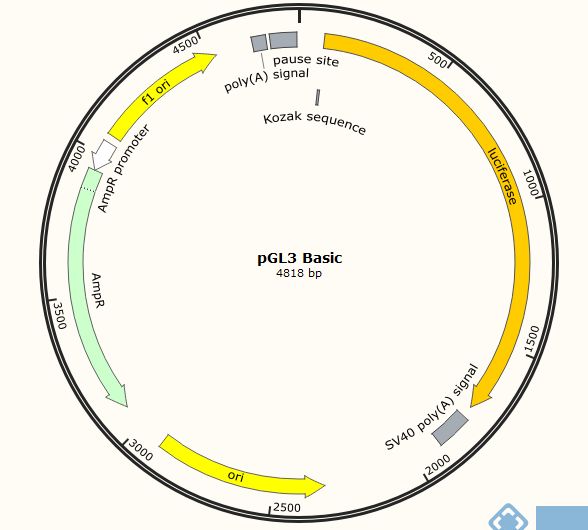
1、 启动子转录活性/转录因子结合位点验证
启动子转录活性对于一个基因表达至关重要,通常做法是:预测启动子序列,默认取转录起始位点上游2000bp作为可能的启动子,将预测得到的序列构建到pGL3 Basic载体萤火虫荧光素酶报告基因的上游,通过报告基因判断启动子活性。与启动子形影不离的就是转录因子的,转录因子对于基因的表达也很关键。我们获得启动子序列后,需要通过专门的软件来预测转录因子在启动子区上的结合位点,根据consensus sequence序列进行突变设计,然后通过于突变缺失组对比,判断转录因子的功能以及在启动子上的结合位点。
2、 microRNA结合位点验证
对于编码基因而言,通常认为microRNA是通过结合到编码基因的3‘UTR来发挥作用。具体做法是:使用专门的网站比如targetscan进行编码基因于3’UTR结合位点预测,获得可能的结合位点后,结合位点上下游延伸100bp左右的序列,将序列构建到pGL3 promoter载体萤火虫荧光素酶报告基因下游。根据萤火虫荧光素酶报告基因判断microRNA是否对编码基因有调控作用。一般做法:同时构建结合位点相应的突变型序列质粒,野生型质粒和突变型质粒做对比。
3、 5’UTR和3’UTR功能验证
对于一个编码基因,通常都会有5’UTR和3‘UTR,有些编码基因他们的5’UTR和(或)3‘UTR可能会对基因的表达有影响。5’UTR具体做法是:将编码基因的5’UTR构建到pGL3 promoter载体萤火虫荧光素酶报告基因的上游,SV40启动子下游,通过这种结构来判断5UTR’对基因表达的影响。而对于3’UTR具体做法是:将编码基因的3’UTR构建到
或者3’UTR构建到pGL3 promoter载体萤火虫荧光素酶报告基因的下游,通过这种结构来预测3’UTR的功能,这里的3’UTR通常都是全长。提供一篇文献Med Sci (Basel). 2017 Dec 22;6(1). pii: E2.The ODC 3'-Untranslated
Region and 5'-Untranslated Region Contain cis-Regulatory Elements: Implications
for Carcinogenesis参考。
4、 增强子/沉默子功能验证
增强子/沉默子功能验证的通常做法是:将增强子/沉默子构建到pGL3 promoter载体SV40启动子的上游,如果确实有增强子或者沉默子功能,那就会影响SV40启动子的活性,通过这种结构来验证功能。
5、 效应元件(response element)功能验证
转录因子效应元件的序列通常都是很短的一段碱基序列,比如p53效应元件,NFkB效应元件。通常做法是:构建这段序列的多个重复,然后后面接一个miniCMV(minimal CMV (miniCMV) promoter is a
low expression synthetic promoter in mammalian cells),然后构建到pGL3 Basic载体萤火虫荧光素酶报告基因的上游进行功能验证。
那萤火虫荧光素酶报告基因还有其他用法吗?答案肯定是:当然有!!这些我认为是比较高大上一些,举例:
1、 萤火虫荧光素酶报告基因做示踪标记干细胞,将目的基因与萤火虫荧光素酶基因融合融合表达,做成转基因小鼠,进行干细胞移植。
2、 用萤火虫荧光素酶报告基因做活体成像来做药效学评价,特别是在抗肿瘤新药研究中应用较多。
3、 类似于荧光蛋白,将荧光素酶基因的C端和N端分别连在两个不同的蛋白质上,若两个蛋白质相互作用,则用成像技术研究活体动物体内他们的相互作用。
