动物平台
CZH
在动物实验中,静脉给药是一种常见的给药方式,静脉注射的药物不经肠壁和肝脏,直接进入体内循环,其药物吸收速度远快于其他给药方式。
在所有常规给药途径中,静脉注射也是最困难的给药方式之一。对于初学者来说,在没有指导的情况下很难上手,成功率极低。今天小编就给大家讲一讲真正给力的静脉给药方法,让新手也可以轻松成功!
静脉注射方法:
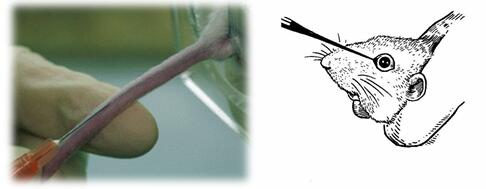
小鼠静脉注射区域主要有两块:一为尾根部左右两侧之静脉,即常说的尾静脉注射;另一为直接由眼球周围注入眼窝之静脉丛,称之为内眦静脉注射。
内眦静脉注射:
相比尾静脉注射,内眦静脉注射的操作更为简单,对于新手来说是更佳的选择。
主要方法为保定小鼠后,持注射器使针头与鼠面成45°夹角,然后刺入下眼睑与眼球之间,刺入深度约2-3mm。
但是该法有不少缺点:注射时容易将针刺入泪腺而使药液从小鼠口腔和鼻腔中漏出;且小鼠也容易挣扎导致跑针;安全程度也比尾静脉给药更差。
所以内眦静脉虽操作简单,但是使用率并不广泛,文献支持也较少,仅作为静脉注射的参考选项。
尾静脉注射:
尾静脉注射相对较难,但是请放心,小编在这里整理了史上最靠谱的尾静脉注射方法,新手也能轻而易举学会!
1、实验前准备:
注射器选择:尾静脉注射选用一般的4号注射器就可以,但小编大多使用一次性的胰岛注射器,它的针头更细,更加适合尾静脉注射。
注射部位选择:小鼠的尾部有 2 条动脉和 3 条静脉 ,2 条动脉分别在尾部的背侧面和腹侧面 ,3 条静脉呈品字型分布,一般采用左右两恻的静脉。
小鼠固定:尤其对于初学者来说,小鼠的固定非常重要,固定不好的话往往会在好不容易进针后,小鼠突然松动,使针头偏离出血管外导致前功尽弃,这样是非常伤士气的。尾注的固定方式主要使用专用的小鼠固定器,如下图。 对于老手,为了方便,也可以直接通过金属笼的孔位拉出尾巴。
2、操作步骤:
对于有毛的小鼠首先拔去沿尾部静脉走向的毛,将小鼠尾巴置于40℃温水中或使用75%酒精反复擦拭尾部,使尾巴血管扩张。
保定方式可以使用固定器,或将小鼠尾巴穿过PC盒铁盖之铁丝间隙,大拇指和食指捏住并拉直尾巴,注意一定要拉紧,不能让老鼠松动。
以酒精消毒后,针头与尾巴呈20至30度角下针,下针时针尖斜面朝上,针尖进入静脉时会有一瞬间通畅的感觉,若仅插入皮下则会持续感到针尖受阻;对于Balb/c类小鼠,针头进入血管后亦可以很清晰的观察到针孔颜色变暗。
开始注入药物时应缓慢, 仔细观察,如果无阻力,无白色皮丘出现,说明已刺入血管,可正式注入药物。
有的实验需反复尾静脉注射给药,注射部位应尽可能从尾端开始,按次序向尾根部移动,更换血管位置注射给药。
注射完毕后用无菌干棉球按压30s止血。
尾静脉的注射量为 5-10ul/g 。
3、经验总结:
3.1 注射前,使小鼠血管充盈可以大大提高注射成功率,尽量选择血管清晰鼓胀发黑的部位进针。
3.2 进针时需尽量避开有白色结节的区域,通常来说有结节说明血管不够充盈或是血管有损伤,若小鼠的尾巴从尾根到尾尖布满密密麻麻的结节,还是放弃该小鼠为妙,就算是老手,难免也会抓狂。
3.3 双手的手臂尽量可以靠在桌边或是找一个支点靠着,以免在注射过程中抖动,导致注射失败。

长按加关注