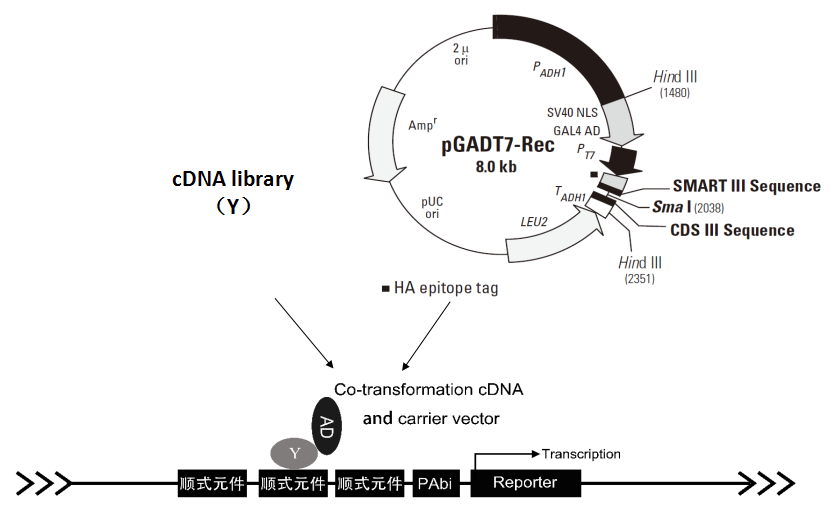
一、酵母单杂交
酵母单杂交技术是在酵母双杂基础上发展而来的一种研究核酸-蛋白相互作用的工具,被广泛用于研究真核细胞内基因的表达调控,如鉴别DNA结合位点发现潜在的结合蛋白基因、分析DNA结合结构域信息等。
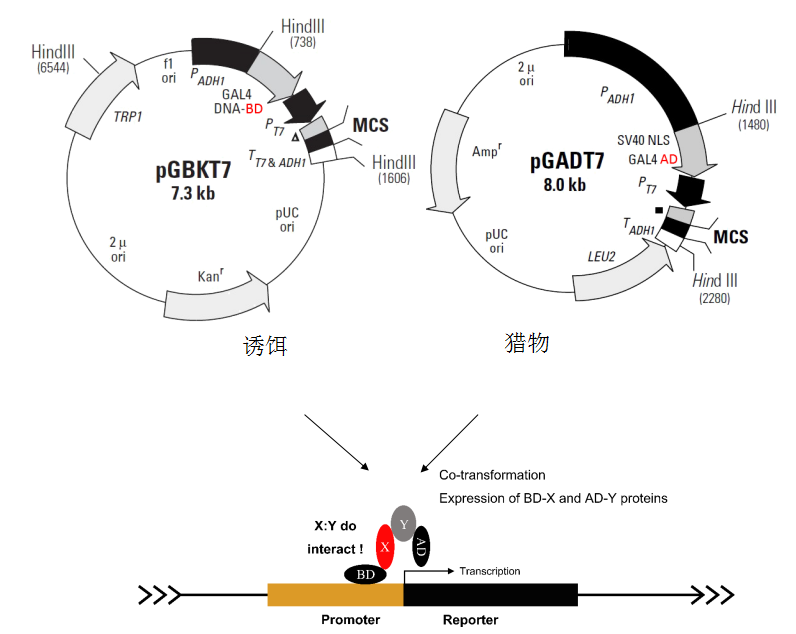
二、核蛋白酵母双杂交
核蛋白酵母双杂交技术最初由Fields等人在研究酵母转录因子GAL4性质时建立,后续经过不断改进已发展成为一种成熟的蛋白-蛋白互作研究工具,具有简便、灵敏、可反映蛋白在活细胞内互作真实情况的特点,被广泛应用于互作蛋白的筛选、蛋白相互作用的鉴定/验证、蛋白互作机理的探究、蛋白连锁图谱绘制等工作。
三、核酵母单/双杂交点对点验证流程简介及图片分析
A为诱饵,B为猎物。
筛选涉及到的报告基因:
(1)HIS3。
(2)ADE2。
(3)MEL1。
诱饵质粒PGBKT7携带trp基因, , 猎物质粒PGADT7携带Leu基因。
筛选涉及到的平板:DDO[SD/-Leu/-Trp],DDO/X[SD/-Leu/-Trp/X-α-gal],TDO /X [SD/-Leu/-Trp/HIS3/X-α-gal],QDO /X[SD/-Leu/-Trp/HIS3/Ade2/X-α-gal]
1、诱饵自激活验证

分析:诱饵质粒重组质粒PGBKT7-A和猎物空载PGADT7共转化Y2Hgold酵母菌株。(1)涂布DDO平板能够生长,说明诱饵PGBKT7-A+ PGADT7已成功转入宿主菌中且对宿主菌无毒性;(2)涂布TDO平板,不能生长,说明诱饵PGBKT7-A+ PGADT7无自激活现象,不能激活宿主菌报告基因his的表达;(3)涂布QDO平板没长,说明诱饵PGBKT7-A+ PGADT7无自激活现象,没有激活报告基因ADE2。
2、共转验证——阴阳性对照
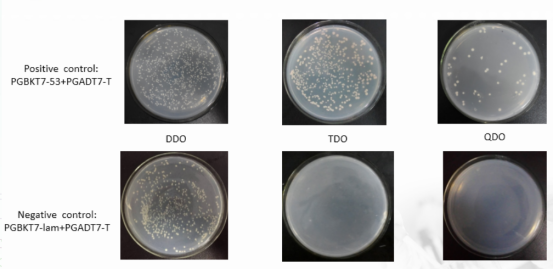
3、共转验证——实验组
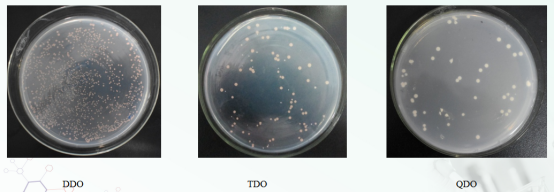
分析:诱饵重组质粒PGBKT7-A和猎物重组PGADT7-B共转化Y2Hgold酵母菌株。(1)涂布DDO平板能够生长,说明诱饵PGBKT7-A+ PGADT7-B已成功转入宿主菌中且对宿主菌无毒性;(2)涂布TDO平板能生长,说明诱饵PGBKT7-A+ PGADT7-B能够互作,激活了宿主菌报告基因HIS3的表达;(3)涂布QDO平板能长,说明诱饵PGBKT7-A+ PGADT7-B能够互作,同时激活了报告基因HIS3和ADE2的表达。
4、双杂点种图


1自激活: Y2H[PGBKT7-A+ PGADT7]
2实验组: Y2H[PGBKT7-A+ PGADT7-B]
3阳性对照: Y2H[pGBKT7-53+pGADT7-T]
4阴性对照: Y2H[pGBKT7-lam+pGADT7-T]
5、酵母单杂点对点验证示意图
P为诱饵启动子,B为猎物。
单杂筛选报告和抗性基因:
AbAr/ AUR-C,AUR1基因的一个显性突变版本,编码肌醇磷酸化神经酰胺syn- thase酶。AUR1-C在Y2HGold/ Y1HGold酵母株中表达,是由于蛋白质与蛋白质的相互作用,使GAL4转录激活和DNA结合域接近。可以添加ABA进行背景抑制。,
诱饵质粒PABAI携带Ura基因,猎物质粒PGADT7携带Leu基因。
筛选所用到的平板:SD/- Leu,SD/- Leu/+AbA

自激活结果分析:PGADT7空载转化含诱饵启动子PAbAi-PY1Hgold酵母菌株。
(1)涂布SD/-Leu平板能够生长,说明诱饵PAbAi-P已成功转入宿主菌中且对宿主菌无毒性;
(2)涂布SD/-Leu/AbA(100ng/ml), SD/-Leu/AbA(200ng/ml) 平板能生长,说明200ng/ml的AbA不能抑制报告基因AbAr/ AUR-C ;
(3)涂布SD/-Leu/AbA(500ng/ml) ,SD/-Leu/AbA(800ng/ml),SD/-Leu/AbA(1000ng/ml)平板没长,说明能够抑制报告基因AUR1-C的最低AbA浓度为500ng/ml,后续可用AbA(500ng/ml)进行共转验证。如果AbA最高抑制浓度1000ng/ml仍然能够生长,则只能考虑截短诱饵启动子。
6、共转验证——阴阳性对照
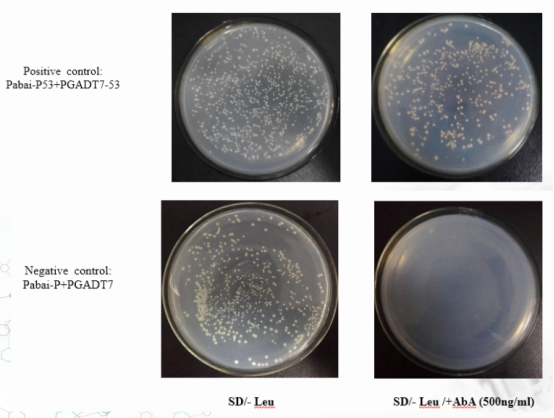 、
、
7、共转验证——实验组
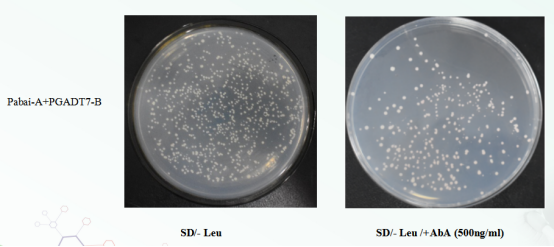
分析:诱饵启动子重组质粒PAbAi-P转化Y1Hgold酵母菌株涂布SD/-Ura平板,挑取单克隆菌制备成感受态,将猎物重组质粒PGADT7-B转化到Y1Hgold【 PAbAi-P 】中。(1)涂布SD/- Leu平板能够生长,说明猎物重组质粒PGADT7-B已成功转入宿主菌中且对宿主菌无毒性;(2)涂布SD/- Leu /+AbA (500ng/ml)平板能生长,说明诱饵PAbAi-P + PGADT7-B能够互作,激活了宿主菌报告基因AbAr/ AUR-C的表达。
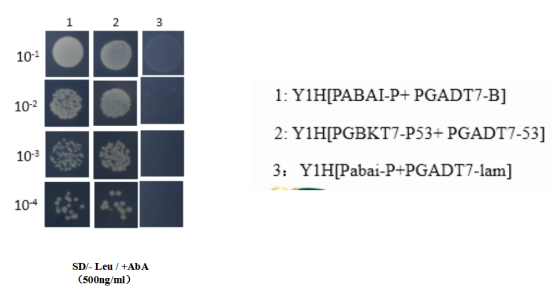
8、单杂稀释点种图
四、酵母单/双杂点对点技术优势:
1. 转化效率高,较少假阴性;
2. 设置严格的对照实验,排除假阳性和假阴性;
3. 酵母双杂系统采用多个报告基因,且每个报告基因上游调控区各不相同,可大幅度减少假阳性;
4. 报告基因整合到染色体上,使基因表达水平稳定,消除了由于质粒拷贝数变化引起基因表达水平波动而造成的假阳性;
5. 严格设置点种验证实验菌体生长状态,进一步验证是否互作及互作强弱;
6. 严格保存原始实验数据便于溯源。