随着高通量测序的发展,lncRNA的研究热度一直居高不下,大量lncRNA得到注释,其通过在转录、转录后水平及表观遗传方式调控基因的表达,参与机体的生长发育过程。
如NEAT1-1 m6A通过上调Pol II磷酸化促进肿瘤的发生转移1;GATA6-AS1可作为调节因子影响GATA6的表达,参与内胚层的分化过程2。而对于刚接触lncRNA的科研小白,要想研究其功能及调控机制,需要了解以下2个关键点。
一、lncRNA的敲除和过表达
研究lncRNA对下游靶基因的调控机制时,一定少不了对lncRNA进行敲低、敲除和过表达。敲低lncRNA最常用的做法是利用RNAi降解RNA,实现转录后水平的沉默,降低表达水平。如果要在体内敲低某lncRNA时,只需将包装好的含shRNA序列的病毒感染目的细胞,即可实现lncRNA的敲低3,这种方式对编码和非编码基因都适用。
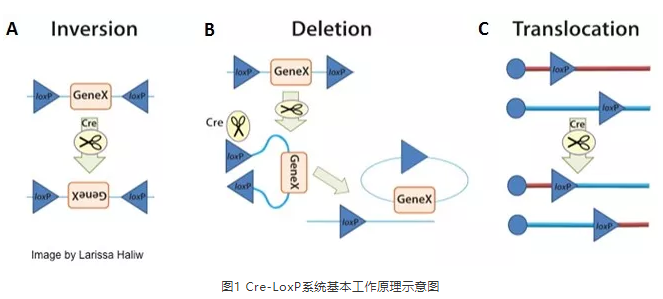
而对于lncRNA的敲除,可以通过Cre-loxp和CRISPR-Cas9 2种系统在基因组水平上编辑实现。Cre-loxp是一种重组酶系统,Cre重组酶能够特异性识别loxp位点,并将2个loxp位点间的序列进行删除或重组(详细Cre-loxp系统介绍)。
Cre-loxp系统敲除效率高、敲除彻底,但受限于必须有构建好的Flox小鼠(基因组中目的lncRNA 2侧插入有同向的loxp位点),然后将构建好的Cre酶工具载体注射到小鼠体内,当Cre酶表达后即可删除2个loxp之间序列,实现目的基因的敲除。
CRISPR-Cas9系统包含具有核酸内切酶活性的Cas蛋白和单链sgRNA(single-guide RNA),sgRNA通过识别基因组序列,引导Cas9蛋白切割基因组,当DNA双链发生断裂后,细胞主要通过(NHEJ)非同源末端连接修复断裂口,因此会引入小片段碱基的插入。
对于编码基因,非3倍数碱基的插入会导致移码突变,实现编码基因的敲除,但这种移码突变对lncRNA达不到任何敲除效果。
要想敲除lncRNA,则需要在基因组上lncRNA上下游各设计2个sgRNA对,串联构建至Cas9载体上包装病毒,Cas9蛋白表达即可切除基因组DNA,达到lncRNA敲除的目的(Cas9系统对lncRNA敲除效率及影响敲除效率的因素详见《高效筛选低阳性比例单克隆技巧|CRISPR/Cas9敲除LncRNA或者外显子的效率是多少?》)。
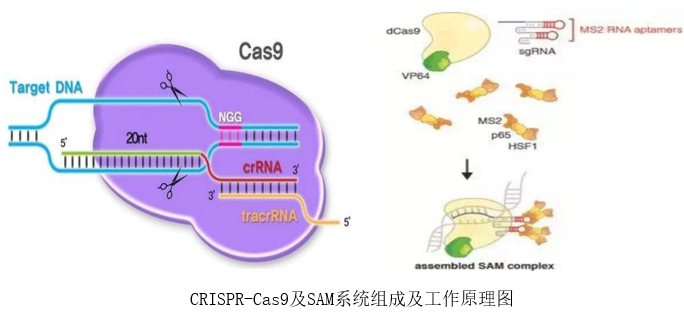
常规过表达lncRNA,只需将目的序列构建至载体中转染细胞即可实现。但对于长度超出载体容量的基因,则需要利用CRISPR-SAM系统,通过失去核酸内切酶活性的dCas9和sgRNA靶向作用,将转录激活因子P65/HSF1/VP64拉到基因启动子区,实现基因的内源性过表达。此外,saRNA技术也能上调基因的过表达(详见《有了这三项技术,90%以上的『基因过表达』可以实现》)。
二、确定lncRNA与蛋白结合的功能区
lncRNA与蛋白的互作是调控机制研究的主流。由于lncRNA长度大于200nt,它不像miRNA一样可以通过种子区调节靶基因的表达。所以,确定lncRNA的功能区域是研究RNA-蛋白互作机制的要点。
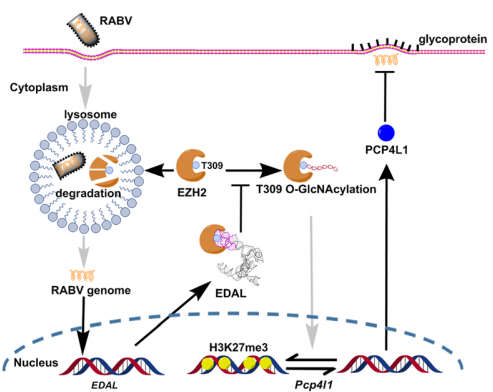
在2020年Genome Biology发表的“A novel antiviral lncRNA EDAL shields a T309 O-GlcNAcylation site to promote EZH2 degradation”文章中,lncRNA EDAL通过抑制组蛋白甲基转移酶EZH2 T309位的O-GlcNAc糖基化,使EZH2降解并抑制狂犬病毒的复制4。该作者研究EDAL功能区及其在EZH2上作用位点的方法值得大家借鉴。
为了研究EDAL的功能区,作者将RNAstructure 5.3预测到的EDAL二级结构分4个小区段验证(A),结果发现EDAL–1(1-304nt)能够降解EZH2,并降低病毒滴度(B)。
接着缺失EDAL–1不同区段进行过表达,发现只有98-153nt组产生同样结果。进一步将该段构建至其他lncRNA 3’端进行相同实验,同样也降低了EZH2表达,因此作者确定了EDAL-1是诱导EZH2降解的关键功能区。
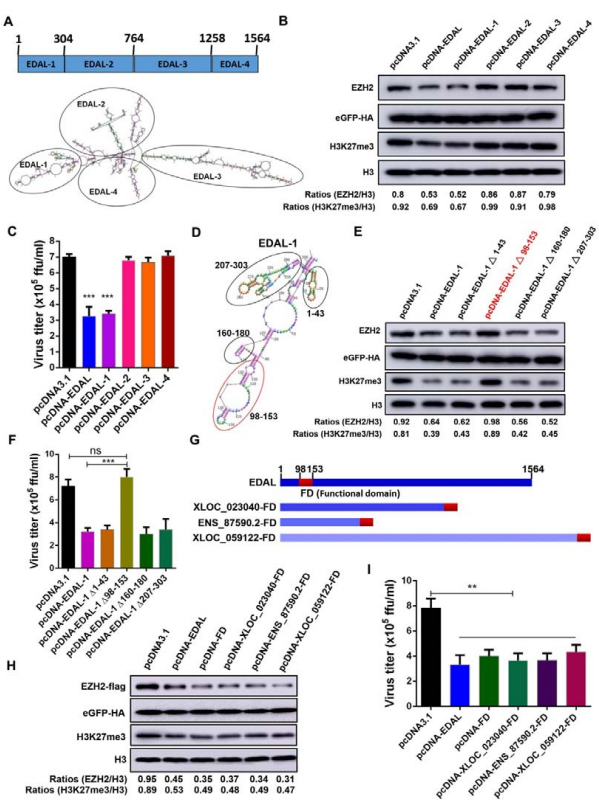
为了进一步验证EDAL与EZH2的作用位点,作者突变了影响EZH2稳定性的磷酸化和O-GlcNAc位点,通过一一排除并结合pull-down、WB等验证出EDAL通过与EZH2 T309 O-GlcNAc位点作用,促进EZH2降解。
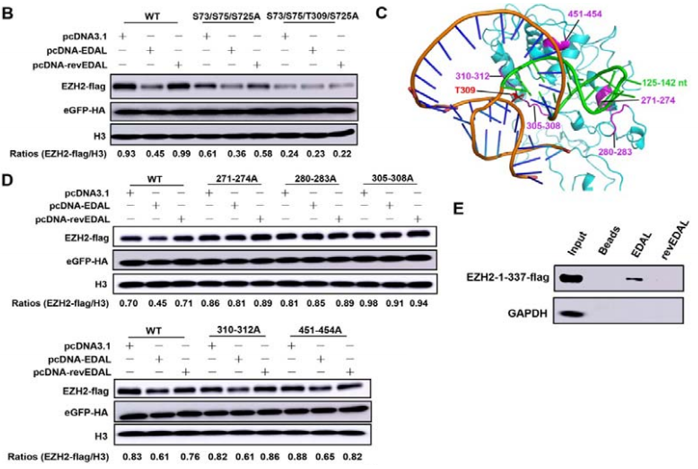
由于生物分子的功能与结构是密切相关的,像该文中作者将lncRNA根据二级结构截短、缺失并进行过表达验证,无疑是确定lncRNA功能区段的。同时,也可以结合RNA-pull down及RIP技术,通过对形成的RNA-蛋白复合物分离、纯化及检测,最终证实lncRNA与蛋白的互作。
吉凯基因可以为客户构建lncRNA的截断和缺失,并提供包括lncRNA在内的基因过表达、敲低和敲除等病毒工具载体,同时也提供RNA-seq、pull-down及Co-IP等服务,助力大家对lncRNA调控机制的研究!

关注公众号,免费领取新人福利——《高分文献资料包》和工具病毒使用手册
(公众号后台回复关键词:文献)
参考文献…
1. Wen S, et al. Long non-coding RNA NEAT1 promotes bone metastasis of prostate cancer through N6-methyladenosine. Molecular Cancer, 2020(171)
2. Yang et al., GATA6-AS1 Regulates GATA6 Expression to Modulate Human Endoderm Differentiation. Stem Cell Reports, 2020
3. Zhu B L, et al. MMP13 inhibition rescues cognitive decline in Alzheimer transgenic mice via BACE1 regulation. Brain, 2019, 142(1): 176–192
4. Sui B, et al. A novel antiviral lncRNA EDAL shields a T309 O-GlcNAcylation site to promote EZH2 degradation. Genome Biology, 2020, 21(1): 228
