尽管使用了基于指南的预防性药物,但动脉粥样硬化性心血管疾病(ASCVD)的残余负担仍然很大。目前的风险评分不能准确地识别出高风险的需要更多强化治疗干预的复发性动脉粥样硬化性心血管疾病(ASCVD)患者。
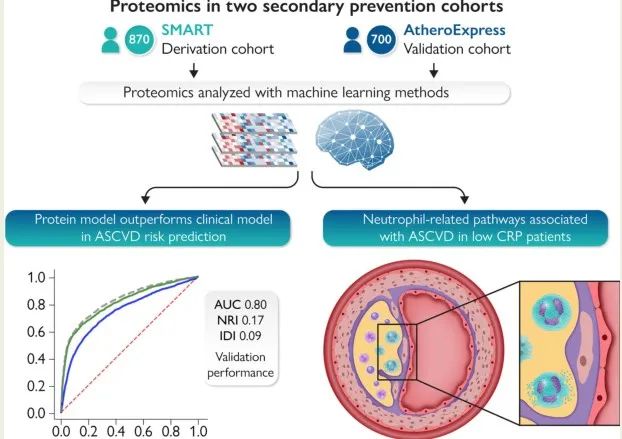
基于蛋白质的风险评分对于改善ASCVD风险预测具有重要意义,因为蛋白质不仅受个体遗传背景的影响,而且还可以反映由于生活方式改变和导致ASCVD风险的特定途径而引起的不利变化,显示出了在二级预防环境中的预测价值。近期,来自荷兰阿姆斯特丹大学的研究团队在两个大型二级预防队列中进行了血浆蛋白质组学研究,使用机器学习分析血浆蛋白质组的进展可能为进一步改善这些患者的危险分层提供新的机会。相关研究结果以“Targeted proteomics improves cardiovascular risk prediction in secondary prevention”为题发表在European Heart Journal(IF 30分)杂志上。

研究结果
1派生队列和验证队列的患者特征
SMART队列870名参与者作为衍生队列(可理解为发现队列/建模队列),Athero-Express队列700名参与者作为验证队列。在派生队列中,263名(30.2%)参与者在中位随访8.0(4.6–12.2)年期间经历了复发性ASCVD事件。主要复发事件包括48例(5.5%)患者的心肌梗死,105例(12.1%)患者缺血性卒中和110例(12.6%)患者死于心血管原因。在验证队列中,130名(18.6%)参与者在中位随访3.0(2.2-3.1)年期间经历了复发性ASCVD事件。在该队列中,原发性复发性ASCVD事件是39例(5.6%)患者心肌梗死,而53例(7.5%)患者有缺血性卒中,38例(5.4%)患者死于心血管原因。采用Olink蛋白质组技术检测心血管II,心血管III和心脏代谢panel的276种蛋白质的水平,其中9种蛋白质因低于检测限值被排除。
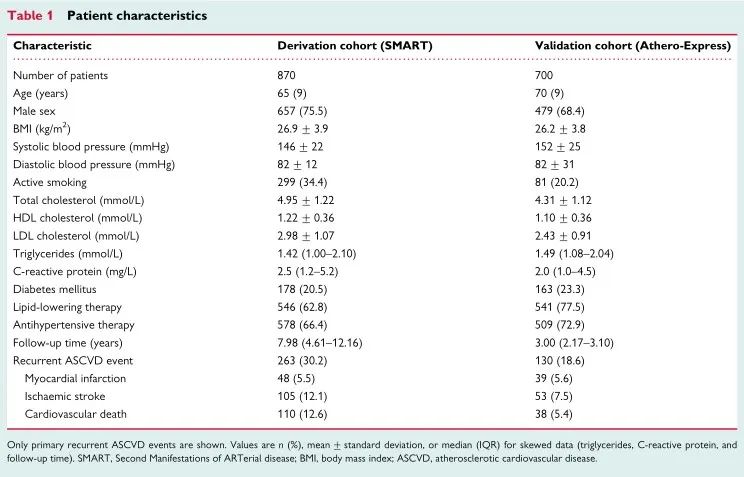
2蛋白质组学风险模型的判别价值
在派生队列中,使用蛋白质模型预测复发性ASCVD事件的ROC AUC为0.810(95%CI 0.797-0.823)。相比之下,临床风险模型的ROC AUC为0.750(95%CI 0.734-0.765)。两种模型组合ROC AUC为0.824(95%CI 0.812-0.835)。蛋白质模型的表现明显优于临床风险模型,而两种模型的组合仅略优于单独的蛋白质模型。
重新校准所有模型后,在验证队列中使用蛋白质模型验证对复发性ASCVD事件的预测结果ROC AUC为0.801(95%CI 0.785-0.817)。相比之下,临床风险模型的ROC AUC为0.765(95%CI 0.743-0.784)。两种模型组合的ROC AUC为0.792(95%CI 0.771-0.811)。在验证队列中,蛋白质模型也优于临床风险模型,而两种模型的组合均不优于单独的蛋白质模型。
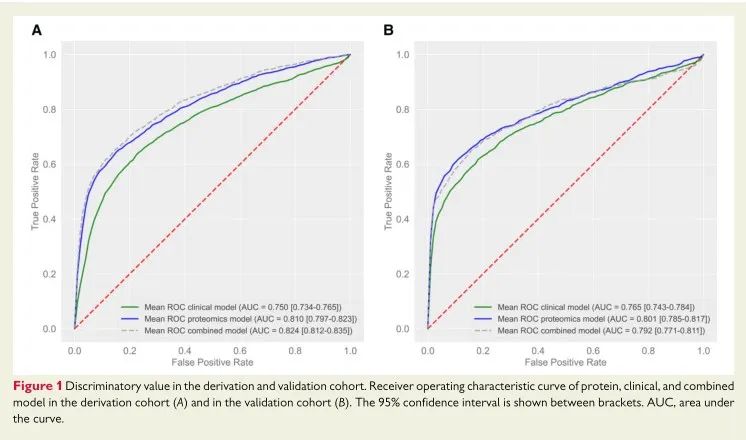
3 蛋白质组学风险模型的校准和重新分类
对派生队列和验证队列的蛋白质模型、临床风险模型以及组合模型进行校准,结果显示这六个模型校准良好,尽管在风险最高的类别中风险略有低估。
我们通过比较蛋白质模型和临床风险模型来计算NRI和IDI。在派生队列中,NRI为0.152(95%CI为0.110-0.196),IDI为0.098(95%CI为0.073-0.122),验证队列中NRI为0.173(95%CI为0.133-0.211),IDI为0.085(95%CI为0.068-0.101)。
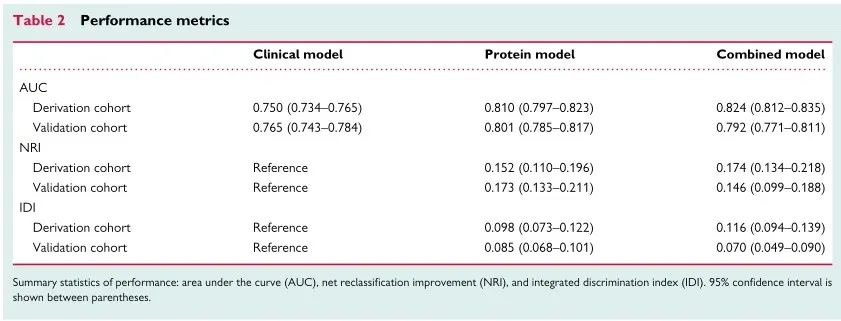
备注:在诊断试验中,我们比较两个模型的优劣时,除了可以比较两个模型ROC曲线下面积外,还可以用定量的指标来比较一个模型比另外一个模型诊断准确率改进的程度。NRI(Net Reclassification Improvement,重分类改善指标)主要用于在设定好的切点水平下,来判断和比较新、旧模型的预测能力是否有所提高。但是NRI的不足之处在于它只考虑了设定某个切点时的改善情况,不能考察模型的整体改善情况,此时就需要用到另一个指标NRI的孪生兄弟--综合判别改善指数(Integrated Discrimination Improvement,IDI)。NRI、IDI与0进行比较,若所得到的NRI大于0则为正改善,小于则为负改善,等于0则为无改善。
4
在临床实践中,C反应蛋白(CRP)用于识别具有“残余炎症风险”的患者。我们根据SMART队列中的CRP水平对患者进行了分类,结果有373名患者被归类为低CRP(≤2 mg/L)与463例分类为高CRP(>2 mg/L)的患者。34名疑似急性炎症发作(CRP>20 mg/L)的患者被排除在分析之外。在低CRP组中,27.3%的患者在随访期间发生ASCVD事件,而高CRP组为32.0%(P=0.13)。与低CRP组相比,高CRP组的白细胞介素6水平要高得多,证实NLRP3-IL6途径的参与导致CRP升高。相反,在低CRP组的前10个预测蛋白中鉴定出四种不同的炎症蛋白(表格中加粗蛋白),其既不在初始模型中也不在高CRP组中,均与嗜中性粒细胞信号传导有关,这意味着在独立于NLRP3-IL6炎性体途径的低CRP组中存在促炎先天免疫激活的作用。
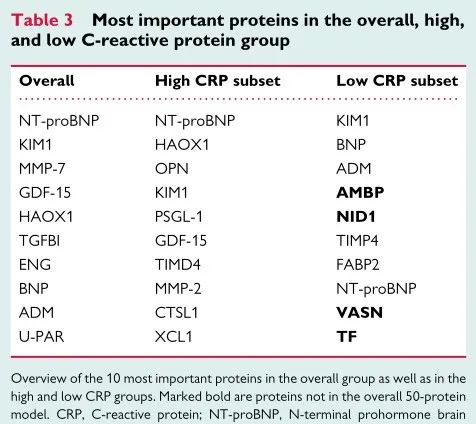
在1570名已确定动脉疾病的患者的两个队列中使用靶向的Olink蛋白质组学,研究显示一组50种蛋白质在预测复发性ASCVD事件方面优于临床风险模型。在派生和验证队列中,蛋白质组学模型在区分方面表现更好,同样校准良好,优于临床风险模型。总的来说,这些数据证实了在二级预防环境中蛋白质组支持的风险分层的潜力。在低CRP患者中发现了中性粒细胞相关的途径,这意味着在传统的NLRP3途径之外还存在着残余的炎症风险。
editorial 评论
心血管领域专家哈佛医学院布莱根妇女医院心血管疾病预防中心的Paul M Ridker教授针对本文发表editorial评论如下:
从基因组转移到转录组到蛋白质组揭示了理解动脉粥样硬化疾病及其进展途径的生物学复杂性增加。编码DNA链转录成mRNA并翻译成特定蛋白质的基因表达过程只是理解随后在蛋白质内发生的日益复杂的生物相互作用的第一步。反过来,蛋白质对细胞,组织,器官和生物体的结构和功能具有不同的影响,包括细胞间信号传导,代谢控制以及生长和衰老的调节。与遗传数据和相关的多基因风险评分(本质上是静态的)不同,蛋白质数据和相关的基于蛋白质的风险评分是动态的,并且对各种环境和行为刺激有反应,包括例如生活方式改变,运动和营养。因此,从基因组学重点转向蛋白质组学重点不仅可以为晚期药物开发(二级预防)提供治疗见解,还可以为早期原始和一级预防提供治疗见解。
吉凯基因可提供“Olink蛋白质组学+机器学习算法”打包产品,助力临床标志物发现,助力临床疾病的一级二级预防以及药物开发,更多详情请咨询当地销售工程师!
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和单细胞测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞(RNA+ATAC)、空间转录组测序等服务。
