我们的Amplite™荧光Caspase 3/7检测试剂盒使用Ac-DEVD-AMC作为Caspase 3/7活性的荧光指示剂。AMC肽几乎不发荧光。 Caspase 3/7对AMC肽的切割产生强荧光AMC,其在440-460nm下荧光监测,激发340-350nm。 它可用于使用荧光酶标仪或荧光计连续测量细胞提取物和纯化酶制剂中Caspase 3/7的活性。百萤生物是AAT Bioquest 的中国代理商,为您提供优质的Caspase 检测试剂/试剂盒。
产品适用仪器
荧光酶标仪
Ex:350nm Em:450nm Cutoff:420nm
推荐孔板:纯黑色孔板
实验方案
96孔板测定示例
概述
用测试化合物制备细胞(100μL/孔用于96孔板或25μL/孔用于384孔板)
加入等体积的Caspase 3/7测定溶液
在室温下孵育1小时
监测Ex的荧光强度 / Em = 350 / 450nm
操作方法
1.准备细胞:
1.1对于贴壁细胞:在生长培养基中将细胞在20,000至80,000个细胞/孔/ 90L过夜,96孔板或5,000至20,000个细胞/孔/ 20L,用于384孔板。
1.2对于非粘附细胞:从培养基中离心细胞,然后将细胞沉淀悬浮于培养基中,培养基浓度为80,000至200,000细胞/孔/ 90L,用于96孔poly-D赖氨酸平板或20,000至50,000细胞/孔/ 20L用于384孔聚-D赖氨酸板。在实验之前,在制动器关闭的情况下以800rpm离心板2分钟。
注意:应对每个细胞系进行单独评估,以确定诱导细胞凋亡的佳细胞密度。
2.准备库存解决方案:
2.1在使用前,在室温下使用组分A,B,C(如果需要,组分D)。
2.2如果需要,制备1mM Caspase 3/7抑制剂Ac-DEVD-CHO储备液:将100μLDMSO(未提供)直接加入到Caspase 3/7抑制剂Ac-DEVD-CHO小瓶中(组分D) )。该抑制剂可用于确认荧光信号强度与Caspase 3/7样蛋白酶活性之间的相关性。
注意:应将未使用的抑制剂储备液等分并在-20°C下干燥储存。
3.准备Caspase 3/7检测溶液:
将50μL200XCaspase 3/7底物储备溶液(组分A)和100μL1MDTT溶液(组分C)加入10mL测定缓冲液(组分B)中,并充分混合。
注意:50μL的200X Caspase 3/7底物储备液足以进行100次分析,每次分析的反应体积为100μL。未使用的200X Caspase 3/7底物储备溶液应等分并在-20°C下干燥储存。远离光明。
4.运行Caspase 3/7测定:
4.1通过在PBS或所需缓冲液中加入10μL10X测试化合物(96孔板)或5μL5X测试化合物(384-板)来处理细胞。对于空白孔(没有细胞的培养基),加入相应量的化合物缓冲液。
4.2将细胞板在37℃,5%CO 2培养箱中培养所需的一段时间(用喜树碱处理的Jurkat细胞4-6小时)以诱导细胞凋亡。
4.3加入100μL/孔(96孔板)或25μL/孔(384孔板)的Caspase 3/7测定溶液(来自步骤3)。
4.4在室温下孵育板至少1小时,避光。
注1:如果需要,在室温下加入测定溶液10分钟前,将1L Caspase 3/7抑制剂Ac-DEVD-CHO的1mM储备液(来自步骤2.2)加入所选样品,以确认caspase 3 / 7个类似的活动。
4.5在制动器关闭的情况下,以800rpm离心细胞板(特别是对于非贴壁细胞)2分钟。
4.6在Ex / Em = 350 / 450nm处观察荧光增加。
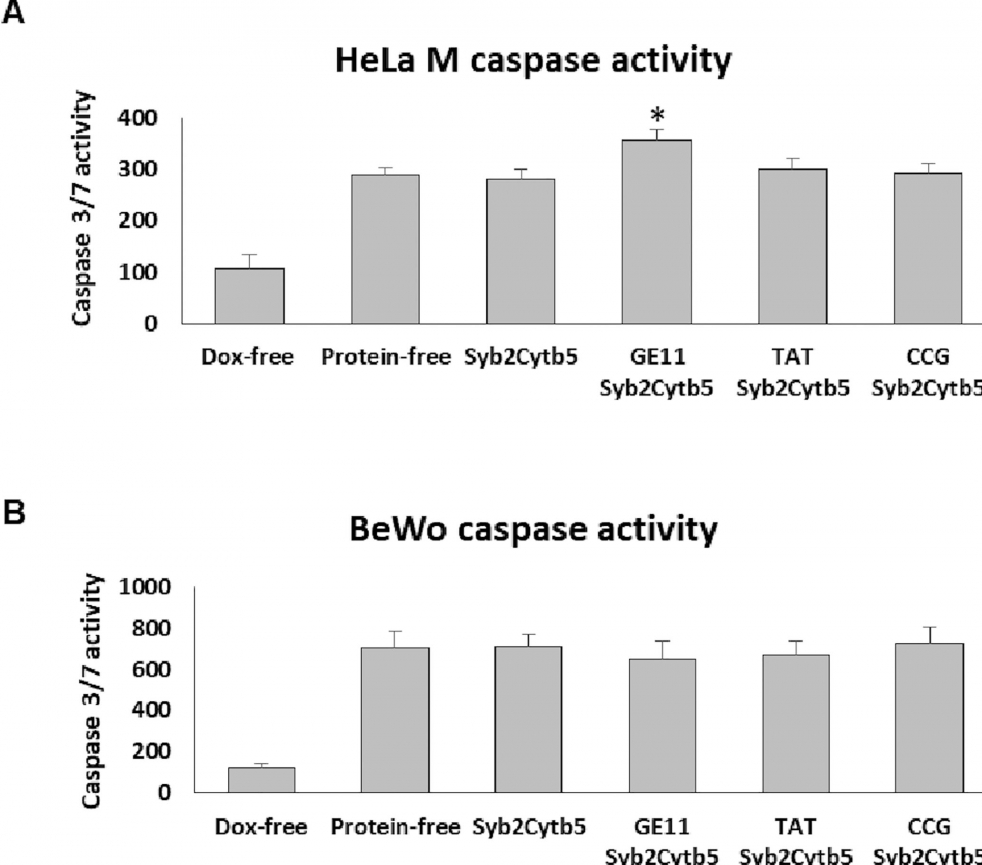
图1。TA 嵌合体对脂质体 Dox 介导的半胱天冬酶3/7活化的影响。将 HeLa M (A)和 BeWo (B)细胞与含有或不含掺入 TA 蛋白的 Dox 载脂质体一起温育。培养48小时后测定半胱天冬酶3和7的活性。显示的值表示为使用未处理的单元格获得的值的百分比。误差棒对应于标准差(n = 3) ,获得的值相对于无蛋白质 Dox 负载的脂质体的显着性是通过单因素方差分析测试(* 表示 p < 0.05)确定的。来源: 牛蛙卵中的唾液酸结合凝集素在体外和体内抑制人类间皮瘤细胞的生长,Takeo Tatsuta 等人,公共科学图书馆,2018年1月。
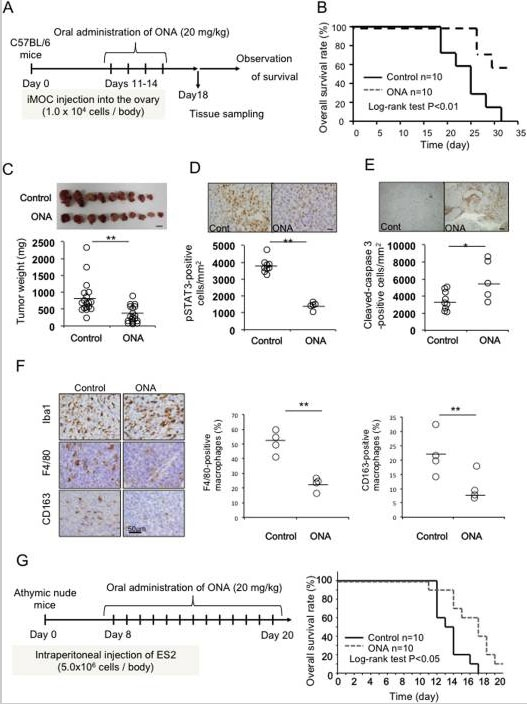
图2。ONA 对小鼠肿瘤进展的影响。作为小鼠卵巢癌模型,C57B6小鼠在右侧卵巢中注射 iMOC 细胞并施用 ONA (20mg/kg) ,如示意图(A)所示。大多数未经处理的 C57B6小鼠在第40天死于癌症转移。评估存活时间(B)和肿瘤重量(C,比例尺: 1厘米)。使用免疫染色评估 STAT3活化(D,比例尺: 20μm) ,半胱天冬酶 -3活化(E,比例尺: 200μm)和巨噬细胞(F)在肿瘤组织中的浸润。报道了 Iba-1阳性巨噬细胞中 F4/80阳性细胞和 CD163阳性细胞的百分比(F)。然后,将裸鼠在腹腔内注射 ES2细胞并给予 ONA (20mg/kg) ,如示意图(G)所示,然后测定存活率(G)。大多数未经治疗的裸鼠在第20天死于癌症转移。来源: 洋葱素 A 通过抑制癌细胞增殖和巨噬细胞的肿瘤功能来抑制卵巢癌的进展。

图3。ONA 联合抗癌药物对 EOC 细胞的联合作用。将 EOC 细胞(SKOV3,es2和 RMG1)与单个抗癌药物(PTX,CBDCA 或 CDDP)和 ONA 的无效浓度的组合温育24小时,然后使用 WST-8测定法(a)测定细胞增殖,并确定每种抗癌药物对每个细胞系的无效浓度。此外,EOC 细胞与抗癌药物和 ONA 一起温育4小时,然后进行半胱天冬酶 -3测定(B)。数据以平均值 ± SD 表示。* 与对照相比,p 值 < 0.05,* * p 值 < 0.01(不含抗癌药物)。此外,将每种 EOC 细胞系(SKOV3: C,ES2: D 和 RMG1: E)与含有或不含 ONA 的每种抗癌药物(PTX,CBDCA 和 CDDP)的无效浓度一起温育3小时,然后通过 Western 印迹分析测量 pSTAT3,STAT3和 β-肌动蛋白,如材料和方法中所述。来源: 洋葱素 A 通过抑制癌细胞增殖和巨噬细胞的肿瘤功能来抑制卵巢癌的进展。
