细胞外基质硬化是软骨老化的典型特征,是导致膝骨关节炎(KOA)的主要原因。然而,与年龄相关的生物物理改变的下游分子和细胞特征尚不清楚。
2023年1月,美国科学家通过对不同年龄和性别的小鼠的膝关节软骨进行形态学检测和蛋白质组学检测,通过分析锁定了一个蛋白α-Klotho,该蛋白在调控膝关节软骨退化中发挥重要作用,并深入挖掘了相关机制。研究成果以“Age-related matrix stiffening epigenetically regulates α-Klotho expression and compromises chondrocyte integrity”为题,发表在Nature Communications(IF:17.694 )上。

研究结果
1. 衰老引起的软骨退化
作者设置了3个年龄段的雌性和雄性小鼠组别,分别是年轻组(4-6个月龄)、中年组(10-14月龄)和老年组(18-24月龄),分别对应人的20-30岁、38-47岁以及56-69岁,并对这6个组别的小鼠胫骨内侧软骨完整性进行了检测(胫骨内侧软骨是最受膝关节炎影响的区域)。检测结果显示,软骨退化从中年开始,这与人类临床相关报道一致。软骨表面的粗糙程度也随着年龄增大而增加。有趣的是,软骨退化程度和表面粗糙程度在雄性小鼠上比雌性小鼠更明显。
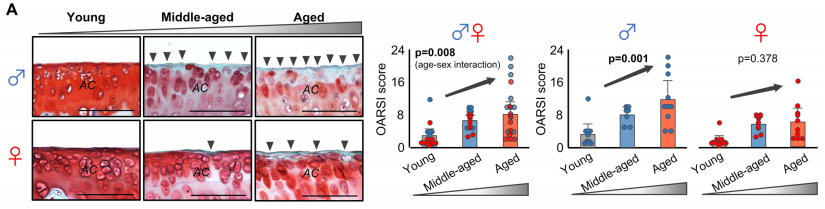
2. 蛋白质组学揭示与年龄和性别依赖的软骨退化相关的信号通路
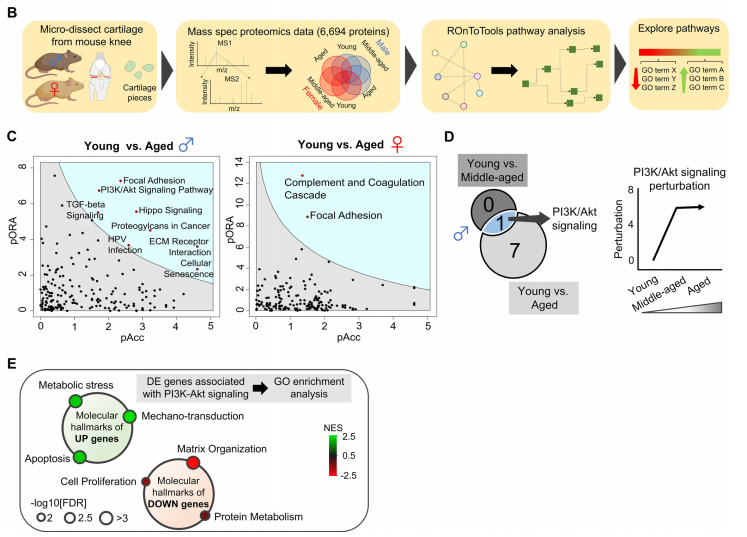
随后,作者对不同性别的各3个年龄段小鼠的关节软骨进行了基于质谱的蛋白质组学检测(共6个组别,每个组别5个生物学重复)。蛋白质组学共检测到了6694个蛋白。与组织学观察的结果相似,和雌性小鼠相比,雄性小鼠随着时间的推移在单个蛋白质表达上呈现出更多的变化。不同性别的年老与年轻组间差异蛋白的KEGG富集分析显示,在雌性小鼠中,有两种通路显著富集,而在雄性小鼠中,有八种通路显著富集。在这些通路中,只有PI3K/Akt信号通路是随着时间在中年就发生改变的。总体来说,作者的结果和此前人关节炎的研究报道类似,PI3K/Akt信号通路发生扰动。GO富集分析结果显示,随着年龄增长上调的蛋白富集在代谢应激、机械转导(mechanotransduction)和凋亡,而下调蛋白富集在基质组织、细胞增殖和蛋白代谢。
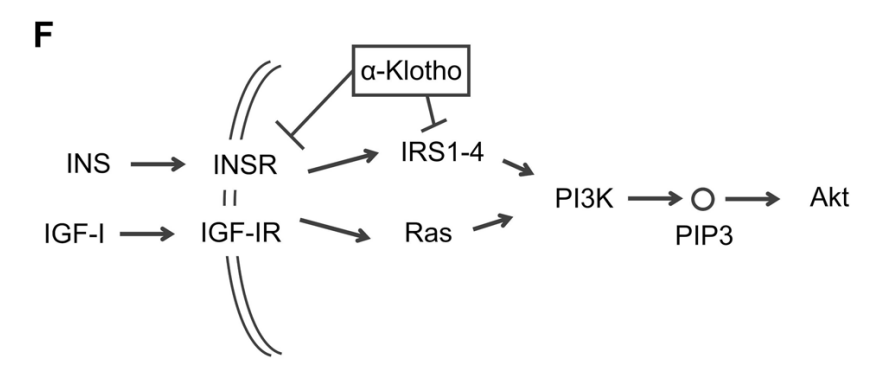
3. α-Klotho敲低驱动雄性小鼠的软骨退化
紧接着,作者挖掘潜在的调控蛋白。IPA分析(Ingenuity pathway analysis)发现激活的INS/INSR信号可能是个重要的调控因子。INS/INSR信号是PI3K/Akt信号的上游信号。因此,作者寻找可以抑制INS/INSR/PI3K轴的调控因子。其中一个关键调控因子就是长寿蛋白α-Klotho。作者分析了一个公开的基因芯片数据,发现在原代软骨细胞中抑制α-Klotho能显著激活PI3K/Akt信号。同时,α-Klotho过表达已被发现在PTOA(创伤性骨关节炎)模型中延缓软骨退化,但α-Klotho是否在衰老相关的KOA(膝关节炎)模型中发挥作用并未被充分研究。因此,作者锁定α-Klotho进行后续研究。
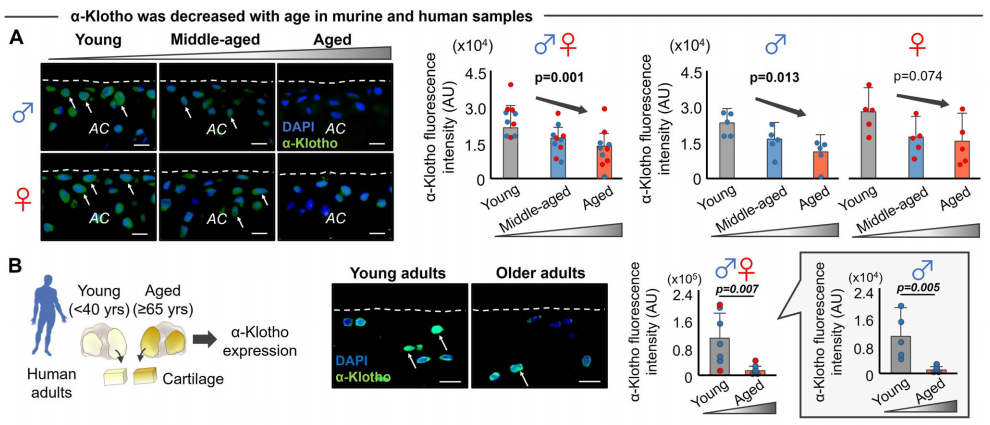
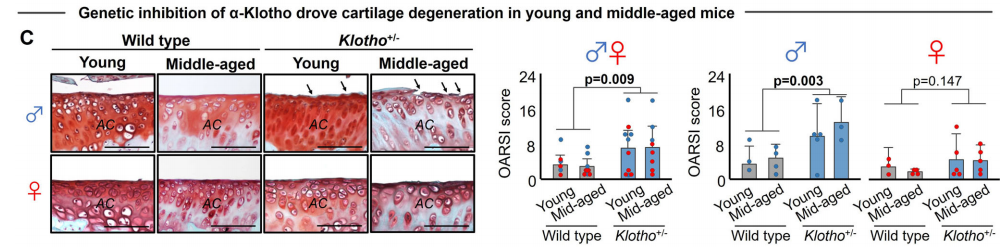
作者检测了小鼠和人软骨中α-Klotho的表达,发现α-Klotho的表达量均随着年龄增长而降低,且与男性中更严重的软骨退化相关。
为了直接评估α-Klotho对软骨健康的影响,作者检测了Klotho杂合缺失(Klotho+/-)小鼠模型中的软骨情况。结果发现,杂合性缺失的年轻和中年雄性小鼠存在加速的软骨退化,而在雌性Klotho+/-小鼠中,并未观察到加速的软骨退化。鉴于这种性别间的差异,作者认为α-Klotho或许是一个性别依赖的、衰老相关膝关节炎的驱动因子。考虑到在雌性小鼠上只呈现了有限的疾病表型,作者只使用雄性小鼠进行后续研究。
4. 年龄相关的α-Klotho减少与小鼠和人软骨细胞的细胞核机械力学相关
前面蛋白质组学的结果显示,在年老的小鼠软骨中机械转导信号发生扰动。这促使作者思考衰老相关的α-Klotho减少是不是微环境中改变的机械信号导致的结果。
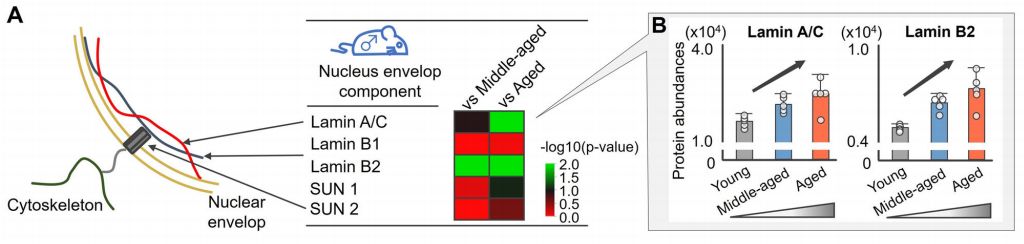
衰老与细胞核机械力学以及核被膜功能障碍的进行性改变相关,这将驱动染色质重塑和基因表达改变。核被膜主要由核纤层(比如,lamin A/C和lamin B)和一个双层膜通过核骨架和细胞骨架复合物的连接组成。特别的是,lamin A/C是一个已知的细胞核完整性调节因子。作者回溯蛋白质组学结果发现,与年轻小鼠相比,年老小鼠的纤层蛋白laminA/C和B2的蛋白质丰度显著增加。
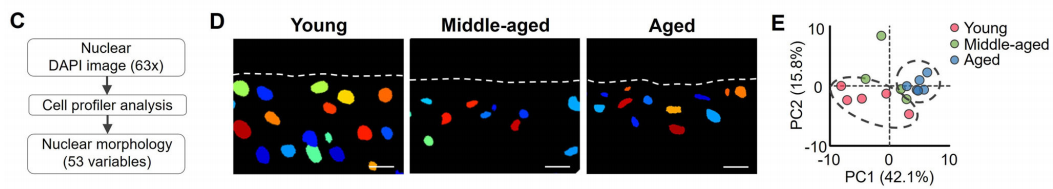
为了进一步表征年龄相关的核被膜变化,作者量化了软骨组织中的软骨细胞核形态,包括大小、形状、强度和结构。53个形态学变量的主成分分析(PCA)显示年轻和年老软骨细胞的细胞核明显分离。
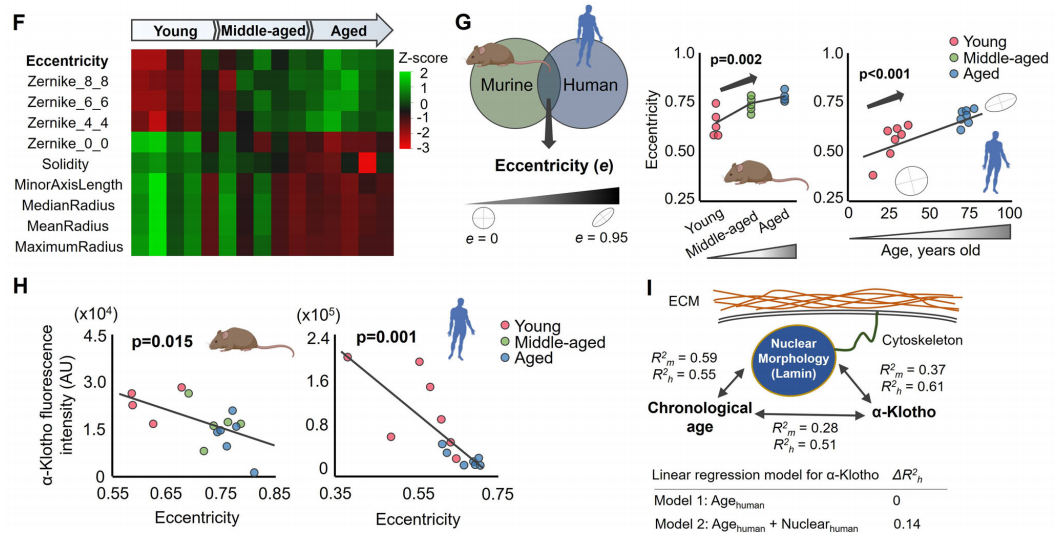
在影响第一主成分的前10个变量中,核离心率(eccentricity)或球形度被发现是小鼠和人类样本中与衰老相关的高度敏感的核形态标志物。值得注意的是,核离心率(eccentricity)的增加(即球形核的减少)也与α-Klotho蛋白水平的降低显著相关。这些结果表明α-Klotho水平的下降可能归因于细胞核机械力学的改变。
5. 基质硬度上升诱导α-Klotho减少并导致年轻软骨细胞产生一种衰老的表型
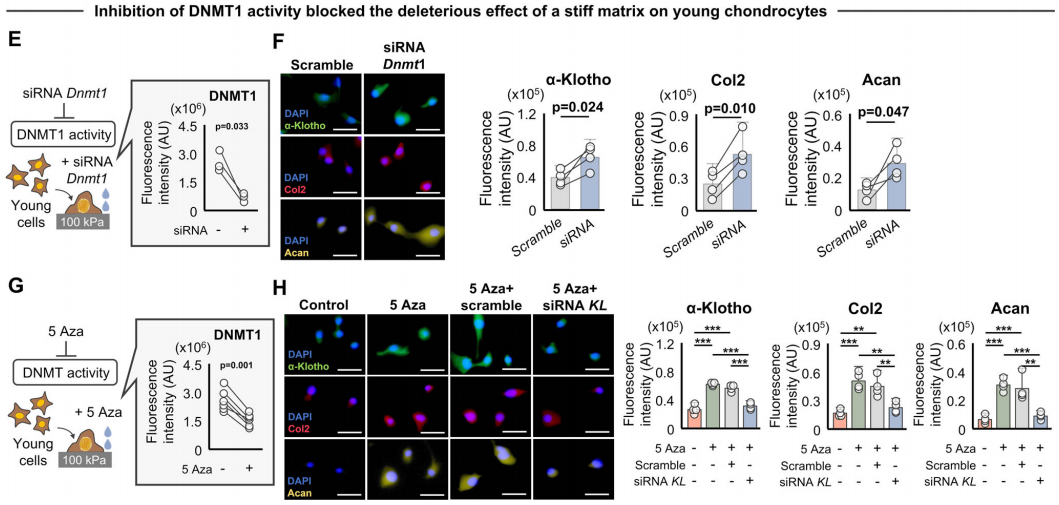
细胞核与微环境机械力学关联,在微环境中,细胞骨架元件会根据外部ECM硬度情况调节细胞核形状。于是,作者进一步研究ECM硬度上升对软骨细胞表型的直接影响。作者将原代软骨细胞“种植”在不同硬度(5kPa、21kPa和100kPa)的聚丙烯酰胺(polyacrylamide,pAAm)凝胶上。与生长在较软基质上的细胞相比,生长在较硬基质上的年轻软骨细胞呈现一种年老的表型,II型胶原蛋白和聚蛋白多糖表达下调,同时伴随着α-Klotho的表达下调。而生长在较软基质上的年老软骨细胞中,以上几个蛋白的表达则上调。
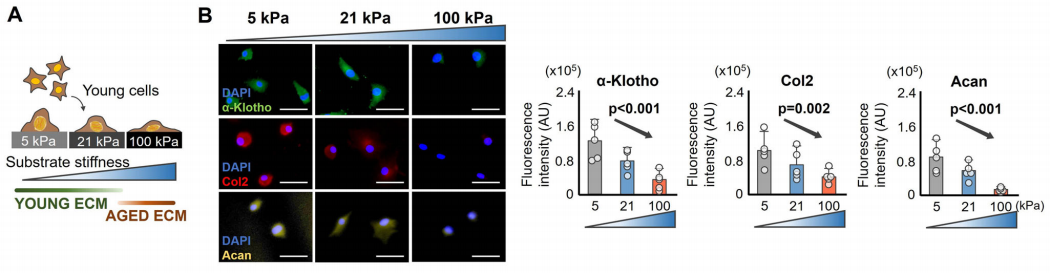
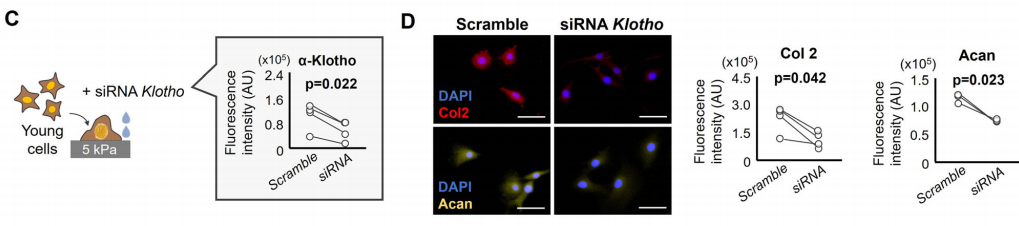
为了检测基质硬度是否直接通过α-Klotho调控软骨形成,作者对生长在软基质上的年轻软骨细胞进行敲低。结果发现,siRNA导致的α-Klotho敲低产生的影响超过了软基质的促软骨形成能力,表现为II型胶原蛋白和聚蛋白多糖的下调。
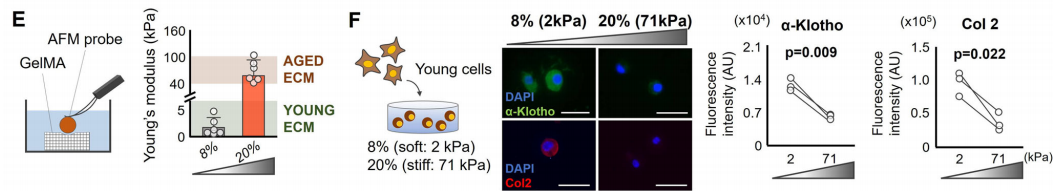
作者继续在3D微环境验证上述现象是否依然存在。结果显示,和2D的生长环境一致,在3D微环境下,年轻软骨细胞在一个硬的3D微环境中也出现了下调的α-Klotho和II型胶原蛋白。总体,2D和3D的结果表明,软的基质能促进年老软骨细胞有一种更年轻的表型,而硬的基质则会加速时间对年轻软骨细胞的影响。
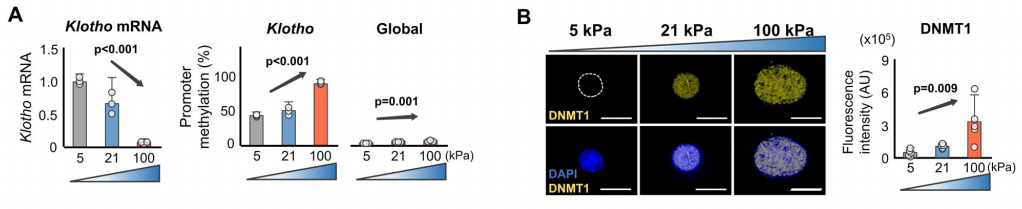
6. 基质硬度通过表观调控α-Klotho的表达
已知机械力诱导核染色体结构调节和表观特征来调控基因转录。因此,研究者检测硬的基质导致的α-Klotho缺失是否是由表观修饰介导的。作者检测了在不同硬度基质上生长的年轻或年老的软骨细胞中Klotho基因启动子区的甲基化。结果显示,硬的基质条件下,年轻软骨细胞Klotho基因启动子甲基化增加,α-Klotho表达下调。相反地,软的基质显著降低Klotho基因启动子甲基化,上调α-Klotho表达。此外,在软的基质促进了年轻和年老软骨细胞的总体DNA甲基化,程度相比Klotho基因启动子甲基化要低。硬度依赖的Klotho基因启动子甲基化也被随着基质硬度升高软骨细胞中升高的DNA甲基转移酶DNMT1表达所印证。
随后,作者通过ChIP实验确认ECM(细胞外基质)硬度增加与上升的DNMT1和Klotho基因启动子结合有关。同时,作者检测到Klotho基因转录减弱。另一个ChIP实验明确了硬的基质是通过在DNMT1启动子区招募Pol II、H3K4M2,而非H3K9M2,最终引起DNMT1表达上调。同时,还发现了c-MYC与DNMT1启动子的结合。C-MYC是个转录因子,受到激酶信号刺激或调控。总体这些发现表明,DNMT1是与硬度介导的信号直接相关的基因。
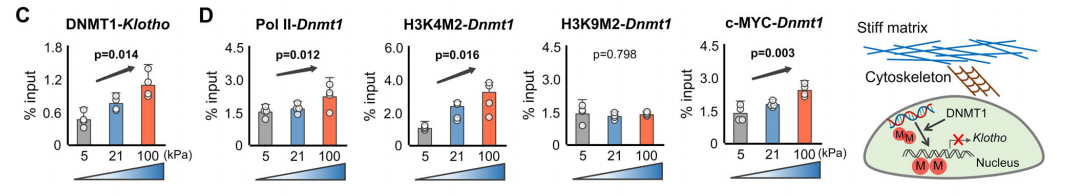
作者通过siRNA敲低DNMT1的表达,DNMT1被抑制后,硬的基质对软骨细胞中α-Klotho的表达和软骨生成的下调作用被挽救。此外,作者还确认了,硬的基质介导的软骨生成下降是通过抑制Klotho实现的。
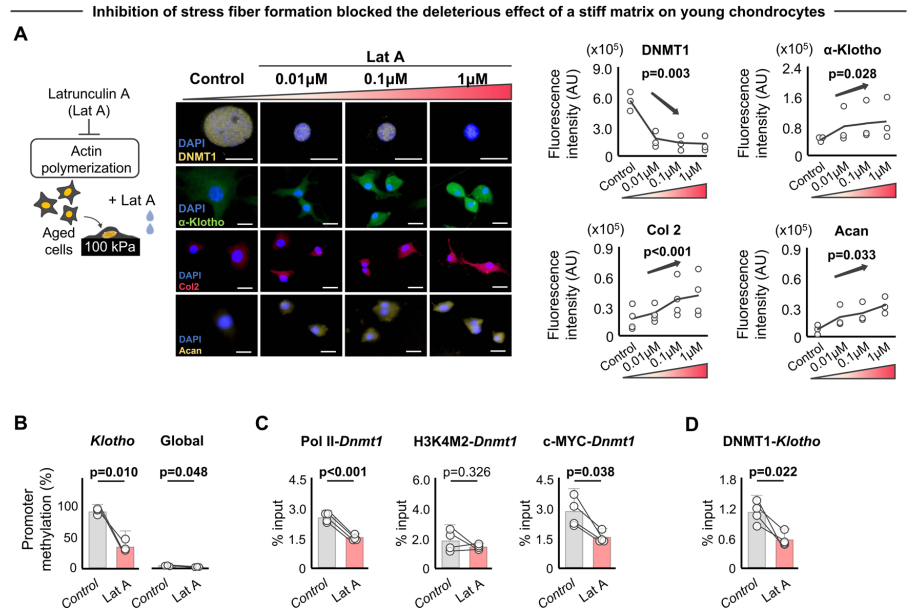
由于来自微环境的外部机械信号通过肌动蛋白细胞骨架传递到细胞核,作者接下来检测细胞骨架的破坏是否抑制硬的基质对下游软骨细胞反应的影响。作者使用肌动蛋白聚合抑制剂lat A处理在硬的基质上培养的老化细胞。lat A消除了应力纤维的形成,降低了核离心率(即增加了细胞核圆度),并降低了lamin A/C的表达,而不影响软骨细胞的活力。肌动蛋白聚合的减少降低了DNMT1的表达,增加了α-Klotho水平,最终恢复了II型胶原蛋白和聚蛋白多糖水平。
lat A处理后α-Klotho水平的增加也伴随着Klotho启动子甲基化水平的降低,但全局DNA甲基化没有显著改变。有趣的是,硬的基质引起的Dnmt1启动子上Pol II和c-MYC结合的增加在lat A处理条件下被消除。因此,作者认为Klotho/Dnmt1的转录机制可能受到机械信号的表观遗传调控。当细胞在硬的基质上培养时,lat A处理也消除了Pol II、H3K4M2和DNMT1在Klotho启动子处结合的变化。使用肌动蛋白纤维形成的抑制剂Y-27632或粘附斑激酶抑制剂PF-562271同样消除了生长在硬的基质上的软骨细胞中DNMT1的增加和α-Klotho的减少。
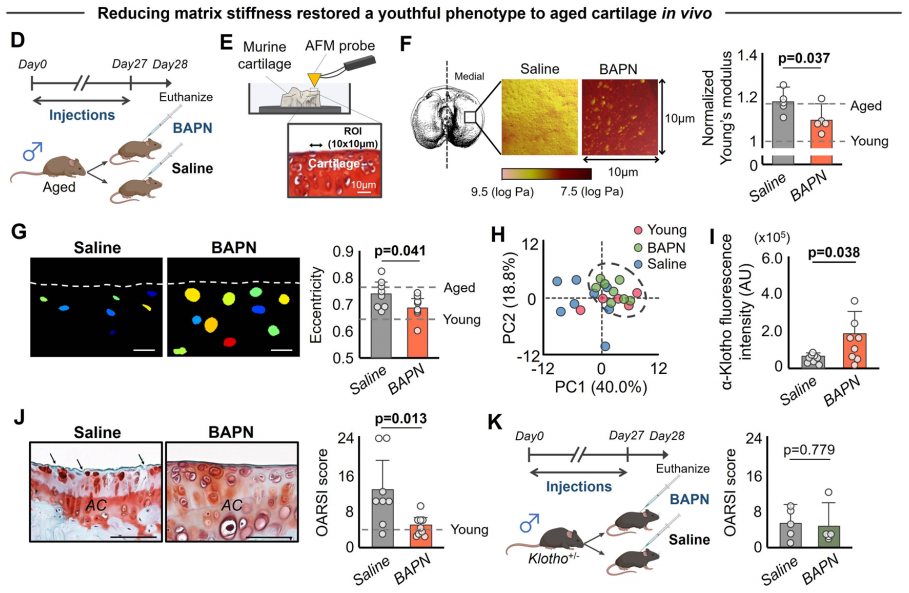
7. 降低ECM硬度可增加α-Klotho的表达并改善衰老小鼠的软骨健康
前述结果提高了通过阻止或者反转基质变硬的靶向ECM机械力学策略来治疗衰老相关膝关节炎的可能性。作者回看了蛋白质组学的结果,发现基于155个ECM蛋白的PCA分析结果中,年老软骨的ECM相关蛋白的表达谱发生了改变。赖氨酰氧化酶(LOX)出现在对PC2有贡献的前20个蛋白质中,并与纤层蛋白lamin A/C正相关。考虑到LOX是参与胶原交联的主要酶之一,并已被证明通过增加ECM硬度来促进PTOA(创伤性骨关节炎),因此LOX引起了作者的兴趣。
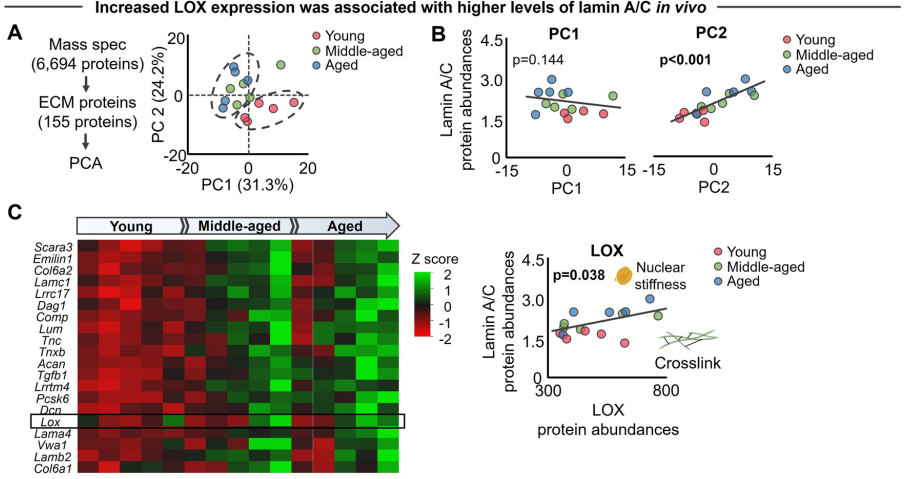
随着年龄增长,软骨硬度增加2-3倍。作者检测是否可通过降低年老小鼠的软骨硬度来改善α-Klotho水平和软骨完整性。作者使用已知的LOX抑制剂β-氨基丙/*(BAPN)降低年老小鼠软骨硬度。连续四周每天注射BAPN可显著降低胫骨内侧软骨的硬度。组织学分析表明,使用BAPN治疗的年老小鼠的软骨细胞显示出与年轻小鼠类似的更球形的细胞核形态。PCA分析进一步证实,经BAPN处理的年老小鼠的软骨细胞表现出更年轻的表型。此外,与体外研究结果一致,在体内降低年老软骨的基质硬度可显著提高α-Klotho水平并改善软骨完整性。然而,在Klotho+/−小鼠中未观察到BAPN对软骨完整性的有益影响,说明注射BAPN后软骨完整性的改善至少部分是由增加α-Klotho水平所驱动的。
研究总结
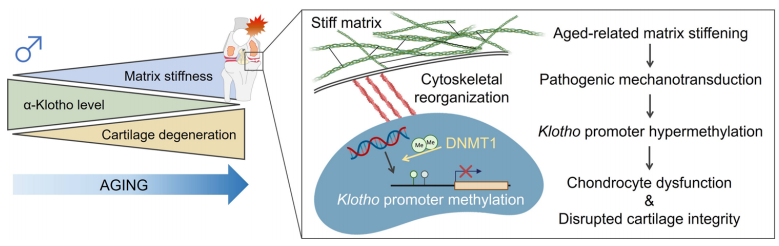
作者通过观测不同年龄段小鼠软骨情况发现,随着年龄增大,软骨退化程度和表面粗糙程度增加。通过蛋白质组学找到了随着年龄增长显著扰动的PI3K/Akt信号通路,并通过分析锁定了一个调控因子α-Klotho。随着年龄增大,α-Klotho蛋白表达下降,且α-Klotho杂合性缺失会加速雄性小鼠的软骨退化。作者进一步发现,衰老诱导的α-Klotho下降与细胞核机械力学相关,进而关联到细胞外基质。深入的机制探索发现,基质硬度的增加驱动了Klotho启动子甲基化,下调Klotho基因表达,并加速体外软骨细胞衰老。而将老化的软骨细胞暴露在柔软的基质中,则能恢复更年轻表型,并增强体内软骨的完整性。作者的研究结果表明,与年龄相关的细胞外基质生物物理特性的改变启动了致病的机械传导信号,促进Klotho启动子甲基化并损害细胞健康。作者的发现可能会超出软骨领域,对衰老研究领域也产生影响。
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务。
