简单高效检测细胞活力
细胞生物学试剂
NEST 为您带来更全面的细胞培养解决方案,在原有的高品质细胞培养耗材产品线的基础上,全面上线针对于培养基(DMEM高糖培养基、RPMI1640培养基、DMEM/F-12培养基、α-MEM 培养基、McCoy's 5A培养基、Leibovitz's L-15培养基)、活力检测(细胞凋亡检测试剂盒、细胞增殖检测试剂盒)、细胞处理(抗生素/支原体清除剂、细胞消化解离试剂、细胞冻存试剂、平衡盐溶液)三大方向所使用的试剂类产品,为高等院校、研究机构、医院、CRO 及 CDMO 企业提供更全面的服务。
在细胞培养过程中,时刻观察细胞凋亡状态及细胞增殖情况有利于实验员做实验整体规划。本文将介绍NEST细胞生物学试剂。
01 细胞凋亡检测试剂盒
细胞凋亡(Apoptosis)是细胞程序性死亡(Programmed Cell Death,PCD)中特有的一种细胞死亡方式,在一系列内源性基因调控下发生,旨在维持内环境稳定。
试剂盒检测原理是什么?
NEST细胞凋亡检测试剂盒采用细胞早期凋亡最常见的检测方法——Annexin V-FITC/PI双染法 (膜联蛋白免疫检测法)。
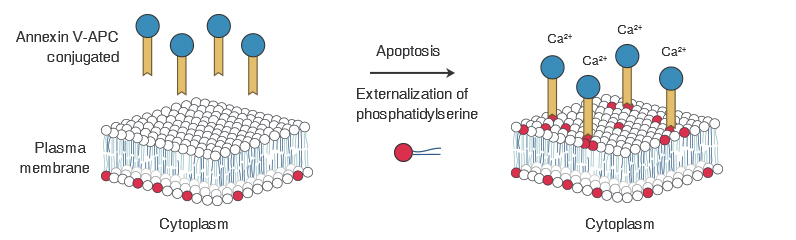
细胞发生凋亡时位于细胞膜内的磷脂酰丝氨酸(Phosphatidylserine, PS)会翻转到细胞膜表面,暴露于细胞外环境中。
Annexin V是一种分子量为35.8KD的Ca2+依赖性磷脂结合蛋白,能够与凋亡的细胞膜表面的PS发生高亲和力特异结合。
利用特异结合特性,NEST细胞凋亡检测试剂盒采用双荧光染色法,以荧光素(如FITC、PE)标记的Annexin V作为荧光探针,核酸染料碘化丙啶(Propidium lodide,PI)作为第二个标记,利用流式细胞仪或荧光显微镜可以区分早期、晚期凋亡细胞以及死细胞。
优 势
Ø 检测早期凋亡最理想的方法之一,不需固定环节从而避免假阳性的产生。
Ø 只需15-20分钟,简便快捷。
Ø 严格可靠的质量控制,保证优异的实验结果
试剂盒操作步骤
1.样品染色
1)将Binding Buffer(10×)稀释成1×Binding buffer工作液备用(1mL Binding Buffer(10×) 需加入9mL无菌去离子水)。
2)收集细胞,加入预冷PBS溶液轻摇或用移液器轻柔吹打洗涤,离心收集细胞,共洗涤两次。
3)在细胞沉淀中加入1×Binding buffer工作液,重悬细胞,使细胞浓度达到1×10^6 个/mL。
4)吸取100μL细胞悬液(细胞总数为1×10^5个)至一新管中,加入5μL Annexin V-FITC 和5-10μLPI,轻轻混匀,室温避光孵育15min。
2. 样品检测
1)流式细胞仪检测:
染色孵育后,每管加入400μL1×Binding Buffer工作液, 混匀后使用流式细胞仪检测。
2)荧光显微镜检测:
染色孵育后涂片,显微镜下观察。使用荧光显微镜上的蓝光和绿光通道分别观察FITC和PI。被 Annexin V-FITC 结合的细胞显示浆膜上有绿色光环。丧失细胞膜完整性的细胞细胞核显示红色,膜上有绿色光环。
注意事项
1)凋亡检测实验中细胞收集及处理是最重要的一环,对于悬浮细胞,可采用500-1000g,离心5min收集细胞。
对于贴壁细胞,用不含EDTA的胰酶进行消化(注:对于比较难消化的细胞,也可以用含低浓度EDTA的胰酶消化,最后细胞多洗几遍,减小EDTA鳌合钙离子产生的影响),500-1000g离心5min收集细胞。贴壁细胞消化时间过长会造成细胞膜的损伤,导致Annexin V结果假阳性。最好是在轻轻吹打可以使贴壁细胞吹打下来时终止消化。
2)Annexin V-FITC 和碘化丙啶(PI)是光敏物质,在保存与操作时需避光。
3)可立式离心管内试剂在开盖前需短暂离心,将盖内壁上的液体甩至管底,避免开盖时液体洒落。
4)PI具有细胞毒性,染色时间不宜过长。为获得准确试验结果,建议样品在染色后1小时内进行分析。
5)在细胞洗涤的最后一步,请尽量将上清弃净,以免 PBS 残留影响实验结果。
试剂盒订购信息

02 细胞增殖检测试剂盒

细胞增殖是指细胞在周期调控的因子下,通过DNA复制等反应,完成细胞分裂的过程。增殖检测一般是分析分裂中的细胞数量的变化,进而反应细胞的生长状态及活性。
试剂盒检测原理是什么?
NEST细胞凋亡检测试剂盒采用CCK-8法。
NEST细胞凋亡检测试剂盒内含有WST-8,是一种类似于MTT的化合物。在存在电子耦合试剂的情况下,WST-8可以被线粒体内的脱氢酶间接还原生成高度水溶性的橙黄色甲膜产物(formazan)。Formazan数量与活细胞的数量成正比。
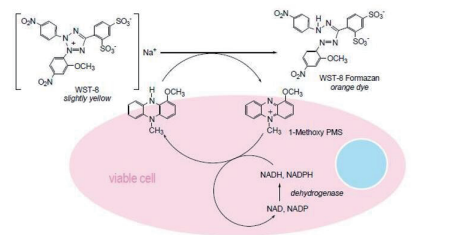
可利用这一特性直接进行细胞增殖和毒性分析,细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。使用酶标仪在450nm波长处测定OD值,可以间接反映活细胞的数量。
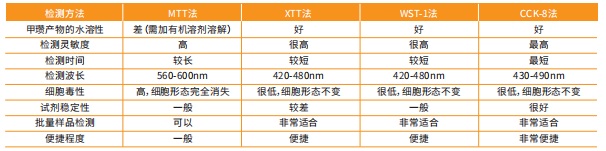
CCK-8法与传统的测试方法相比,具有灵敏性高、反应时间短、线性范围宽,数据可靠、重现性好等特点。
试剂盒操作步骤
1)制备细胞悬液:细胞计数。
2)接种到96孔板中:按比例(例如:1/2比例)依次用培养基等比稀释成一个细胞浓度梯度,一般要做3-5个细胞浓度梯度,每组3-6个重复孔,每孔100μL细胞悬液。
3)37℃培养箱中培养:细胞接种后贴壁大约需要培养24小时,如果不需要贴壁,这步可以省去。
根据实验的实际需求进行后续不同操作
1.制作标准曲线(测定细胞具体数量时)
每孔加入10μLCCK-8增强型溶液,培养箱内孵育一定时间后测定450nm吸光度。
根据吸光度制作出一条以细胞数量为横坐标(X轴), 吸光度为纵坐标(Y轴)的标准曲线。根据此标准曲线可以测定出未知样品的细胞数量。
2.细胞活性检测
每孔加入10μLCCK-8增强型溶液,培养箱内孵育0.5-4小时后在酶标仪下测定450nm吸光度。
3.细胞增殖-毒性检测
在每孔加入0-10μL不同浓度的待测药物后置于37℃培养箱中培养。根据待测药物的性质和细胞的敏感性来设计细胞培养时间, 一般要根据细胞周期来决定,起码要一代以上的时间。
如果待测药物有氧化性或还原性的话,除去培养基,并用培养基洗涤细胞两次,加入新的培养基后在每孔加入10μL CCK-8增强型溶液,培养箱内孵育0.5-4小时后在酶标仪下测定450nm吸光度,从而去除药物影响。
药物影响比较小的情况下,可以不更换培养基,直接扣除培养基中加入药物后的空白吸收即可。
吸光度建议采用双波长进行测定,检测波长450-490nm,参比波长600- 650nm。
4.计算公式
细胞存活率 = [(As - Ab)/(Ac - Ab)] ×100%
抑制率 = [(Ac - As)/(Ac - Ab)] ×100%
As :实验孔(含有细胞的培养基、CCK-8、待测药物)的吸光度
Ac:对照孔(含有细胞的培养基、CCK-8、没有待测药物)的吸光度
Ab :空白孔(不含细胞和待测药物的培养基、 CCK-8)的吸光度
注意事项
1)由于每孔加入CCK-8量比较少,有可能因试剂沾在孔壁带来误差,建议在加完试剂后轻轻敲击培养板以帮助混匀,或者直接配制含10% CCK-8的培养基,以换液的形式加入。
2)因细胞种类不同,加入CCK-8增强型溶液后孵育形成的Formazan的量也不一样,需要根据显色情况调整孵育时长。对于大多数情况孵育1小时即可。如果显色不够的话,可以继续培养,以确认最佳条件。特别是血液细胞形成的Formazan很少,需要较长的显色时间,如5-6 小时。
3)如果暂时不测定吸光度,为避免吸光度变化,可以向每孔中加入10μL0.1M HCl溶液或1%w/vSDS溶液,遮盖培养板室温下避光保存。最多维持24小时。
试剂盒订购信息

