Heck反应简介
Heck反应是有机化学中最为广泛使用的碳-碳偶联反应之一。Heck反应是烯烃与芳基或乙烯基卤化物(或三氟甲磺酸酯)用于合成取代烯烃的钯催化交叉偶联反应。该反应需要在碱性条件下进行,同时还具有高度的区域选择性和立体专一性。[1,2] Heck反应由Richard F.Heck和Tsutomu Mizoroki在20世纪60年代末首次发现,因此Heck反应也被称为Mizoroki-Heck反应。[3] Mizoroiki-Heck也凭借这一反应获得了2010年诺贝尔化学奖。[4]
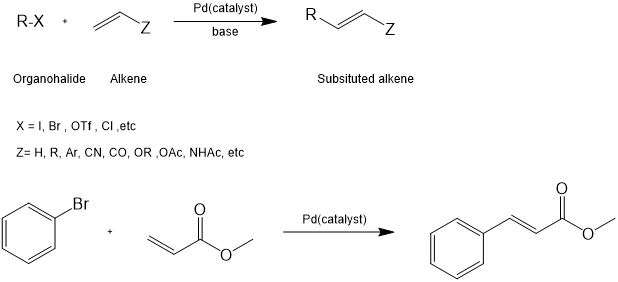
图1. Heck反应
Heck反应机理
Heck反应是一种在强碱和钯催化剂的存在下,以烯烃与有机卤化物为原料进行的交叉偶联反应,主要通过以下四步机理进行:
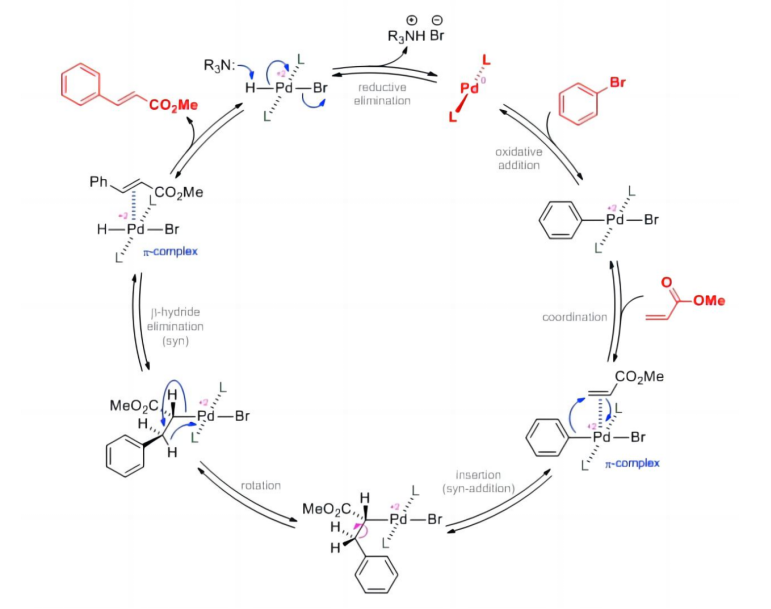
1. 氧化加成
2. 迁移插入
3. β-H的消除
4. 还原消除
Heck反应机理在很大程度上取决于钯催化剂、配体和碱的选择。通过改变这些因素,可以针对各种底物优化反应。Heck反应是有机合成中构建碳-碳键的重要反应之一,并在该领域取得已了重大进展。
Heck反应影响因素
以下几个因素会影响Heck反应的效率和选择性,包括:
1.钯催化剂的选择:钯催化剂的选择会显著影响反应结果。不同的钯配合物具有不同的反应性和选择性,选择合适的催化剂可以提高反应的产率和选择性。
2.配体结构:配体的选择也会影响反应结果。配体在形成稳定钯络合物和控制其反应性方面起着至关重要的作用。不同的配体可以促进不同的反应途径并改变反应的选择性。
3.碱的选择:碱可以通过控制反应混合物的酸度和促进烯烃的去质子化来影响反应结果。不同的碱可以影响反应的速率和产物的选择性。
4.底物结构:底物的结构可以显著影响反应结果。底物的电子和空间特性会影响反应速度、产物的选择性和副产物的形成。
5.反应条件:反应条件,包括温度、溶剂和反应时间,也会影响Heck反应的效率和选择性。可以通过优化这些因素提高反应的产率和选择性。
Heck反应应用
Heck反应可用于以下应用:
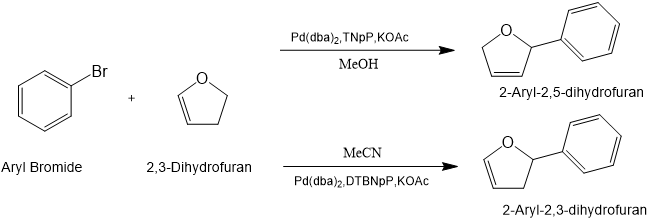
1,在新戊基膦配体在芳基溴化物与烯烃偶联中的应用中发现,烯烃异构化程度由配体的选择控制。其中,在Pd(dba)2作为催化剂的条件下,二叔丁基新戊基膦(DTBNpP)可以提高反应中对2-芳基-2,3-二氢呋喃的选择性,三新戊基膦(TNpP)则可以提高反应中对异构2-芳基-2,5-二氢呋喃的选择性。[5]
上述合成方案:
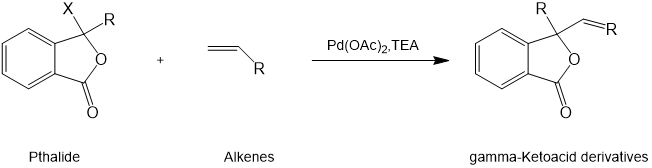
1,在二恶烷溶剂中,在Pd(OAc)2催化剂和三乙胺(TEA)条件下,苯酞与不同烯烃进行Heck偶联反应,以高产率有机合成得到γ-酮酸衍生物。[6]
上述合成方案:
1,二叔丁基二氮茚酮通过Heck反应合成吲哚啉。吲哚啉在合成化学领域中是极具生物意义的重要化合物之一。[7]
2,Heck反应可高效合成各种邻三氟乙基取代的苯乙烯。[8]
3,Heck反应可高兼容性的合成黄酮和新黄酮等重要的苯并吡喃衍生物。[9]
4,在不使用过渡金属催化剂的情况下,即可通过Heck反应产生二苯乙烯衍生物。[10]
Heck反应研究与趋势
1,关于新戊基膦配体在芳基溴化物与烯烃Heck偶联反应应用中的研究。发现在环烯烃的Heck偶联中,发现烯烃异构化程度由配体的选择控制。[5]
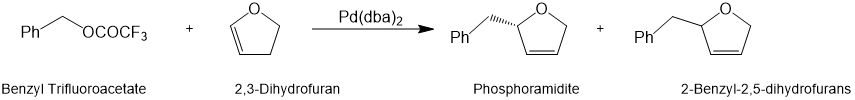
2,关于使用亚磷酰胺作为一种新型高效手性配体进行苄基亲电子体的不对称Heck偶联反应。以苄基三氟乙酸盐和2,3-二氢呋喃作为原料,亚磷酰胺作为配体进行的Heck偶联反应,收率理想且立体选择性优异,可得到主产物2-苄基-2,5-二氢呋喃。[11]
上述合成方案:
Heck反应的局限性
Heck反应具有以下几点局限性:
官能团耐受性:受酸敏感和碱敏感基团存在的限制。这些基团会在反应过程中不可逆地失活或发生副反应。
空间位阻:底物或配体上大量取代基的存在会阻碍反应或改变产物的选择性。
区域选择性:反应有时会表现出较差的区域选择性,特别是在末端烯烃的情况下。非目标区域异构体的形成会限制反应的效率和选择性。
催化剂中毒:钯催化剂因反应混合物中的杂质或某些官能团的存在而失活或中毒。
实验成本:反应所使用的钯催化剂的成本可能很高,限制了其在某些应用中的实用性。
尽管如此 ,Heck反应仍然是有机合成中C-C键形成的重要反应。新型钯催化剂、配体和反应条件的开发有助于克服其中的一些限制,并提高反应的收率以及区域选择性。
阿拉丁提供相关产品,详情请见阿拉丁官网:Heck Reaction (aladdin-e.com)
参考文献
1.Biffis A, Zecca M, Basato M. 2001. Palladium metal catalysts in Heck C?C coupling reactions. Journal of Molecular Catalysis A: Chemical. 173(1-2):249-274. https://doi.org/10.1016/s1381-1169(01)00153-4
2.Li JJ. 2009. Name Reactions. https://doi.org/10.1007/978-3-642-01053-8
3.Oestreich M. 2009. The Mizoroki?Heck Reaction. https://doi.org/10.1002/9780470716076
4.Ruan J, Xiao J. 2011. From ?-Arylation of Olefins to Acylation with Aldehydes: A Journey in Regiocontrol of the Heck Reaction. Acc. Chem. Res.. 44(8):614-626. https://doi.org/10.1021/ar200053d
5.Lauer MG, Thompson MK, Shaughnessy KH. 2014. Controlling Olefin Isomerization in the Heck Reaction with Neopentyl Phosphine Ligands. J. Org. Chem.. 79(22):10837-10848. https://doi.org/10.1021/jo501840u
6.Shashikumar ND, Krishnamurthy G, Bhojyanaik HS. 2014. A Facile Synthesis of Novel Cyclic Esters of ?-Keto Acid Derivatives by Heck Coupling Reaction. J. Heterocyclic Chem.. 51(S1):E354-E357. https://doi.org/10.1002/jhet.1898
7.Zheng H, Zhu Y, Shi Y. 2014. Palladium(0)-Catalyzed Heck Reaction/C?H Activation/Amination Sequence with Diaziridinone: A Facile Approach to Indolines. Angew. Chem.. 126(42):11462-11466. https://doi.org/10.1002/ange.201405365
8.Zhang H, Chen P, Liu G. 2014. Palladium-Catalyzed Cascade C?H Trifluoroethylation of Aryl Iodides and Heck Reaction: Efficient Synthesis ofortho-Trifluoroethylstyrenes. Angew. Chem. Int. Ed.. 53(38):10174-10178. https://doi.org/10.1002/anie.201403793
9.Khoobi M, Alipour M, Zarei S, Jafarpour F, Shafiee A. 2012. A facile route to flavone and neoflavone backbones via a regioselective palladium catalyzed oxidative Heck reaction. Chem. Commun.. 48(24):2985. https://doi.org/10.1039/c2cc18150a
10.Shirakawa E, Zhang X, Hayashi T. 2011. Mizoroki-Heck-Type Reaction Mediated by Potassium tert-Butoxide. Angew. Chem.. 123(20):4767-4770. https://doi.org/10.1002/ange.201008220
11.Yang Z, Zhou J(. 2012. Palladium-Catalyzed, Asymmetric Mizoroki?Heck Reaction of Benzylic Electrophiles Using Phosphoramidites as Chiral Ligands. J. Am. Chem. Soc. 134(29):11833-11835. https://doi.org/10.1021/ja304099j

