阿尔兹海默症(Alzheimer disease,AD)是最常见的精神退行性疾病,以认知障碍为主要临床表现,其护理和治疗为患者家属和社会都带来沉重负担。
AD新药靶点以及作用于新药靶点的药物探索是科学家和药企正在攻克的主要难题。β-淀粉样蛋白(β-amyloid,Aβ)沉积是阿尔兹海默症的主要发病机制之一。
自噬是溶酶体介导的一种普遍存在的机体内细胞降解自身细胞器以及功能异常蛋白的过程,是细胞自稳的保护机制。
过氧化物酶体增殖活化受体α(PPARA)是PPAR家族的一个成员,可通过靶向目的基因启动子区域的PPAR反应元件从而对参与糖脂代谢以及炎症反应的基因进行调控,从而在细胞分化、发育以及糖脂代谢起关键作用,研究发现PPARA基因的遗传变异与AD风险相关,但其在阿尔兹海默症发病机制中具体的分子机制尚不清楚。
2019年4月,中国科学院昆明动物研究所在权威期刊杂志《Autophagy》(影响因子:11.1)发表了题为“Activation of PPARA-mediated autophagy reduces Alzheimer disease-like pathology and cognitive decline in a murine model”的文章,阐明了核受体过氧化物酶体增殖活化受体α激动剂吉非罗齐和匹立尼酸抗阿尔茨海默症的分子机制。

该项研究首次揭示PPARA的激动剂吉非罗齐和匹立尼酸通过激活PPARA介导的自噬发挥其在AD中的保护功能,老树开新花,提出抗高血脂药物可用于AD治疗的新视点;探讨了小胶质和星型胶质细胞在AD治疗中的作用,为理解和防治AD提供了新思路和新靶标。
分子层面
首先在分子层面,作者发现PPARA的激动剂吉非罗齐(gemfibrozil)和匹立尼酸(Wy14643)能够诱导体外培养的人源小胶质(HM)细胞自噬标志性蛋白LC3B-II/LC3B-I比值的升高以及SQSTM1/p62的降低(图1b,d)。
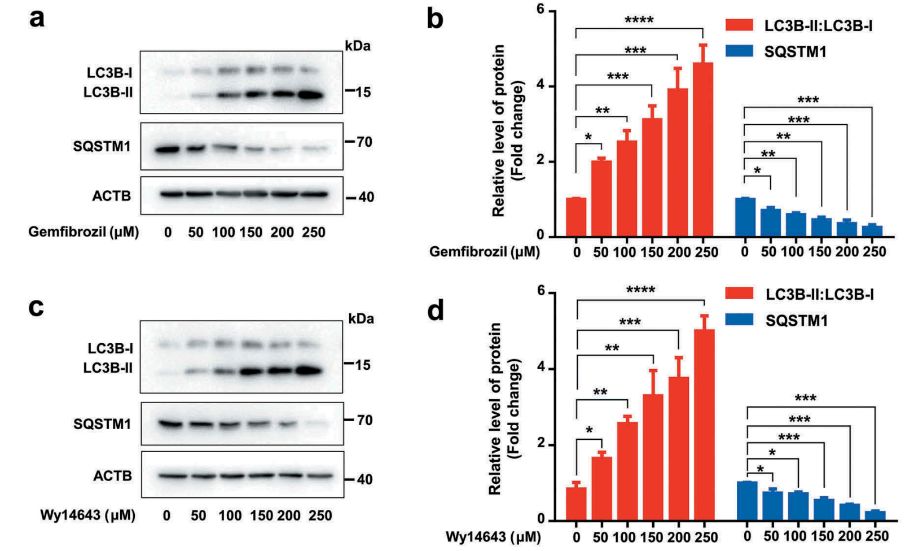
图1. PPARA激动剂诱导人源小胶质细胞自噬
细胞层面
在细胞层面,作者使用了吉凯基因提供的mRFP-GFP-LC3双荧光慢病毒自噬流检测系统感染HM细胞。mRFP在自噬溶酶体中稳定表达,吉非罗齐和匹立尼酸能够在HM细胞产生与rapamycin(自噬诱导剂)相同的自噬流增加的效应(图2a),并且该效应可以被PPARA的siRNA阻断,提示PPARA是吉非罗齐和匹立尼酸介导的细胞自噬现象的正向调节因子。
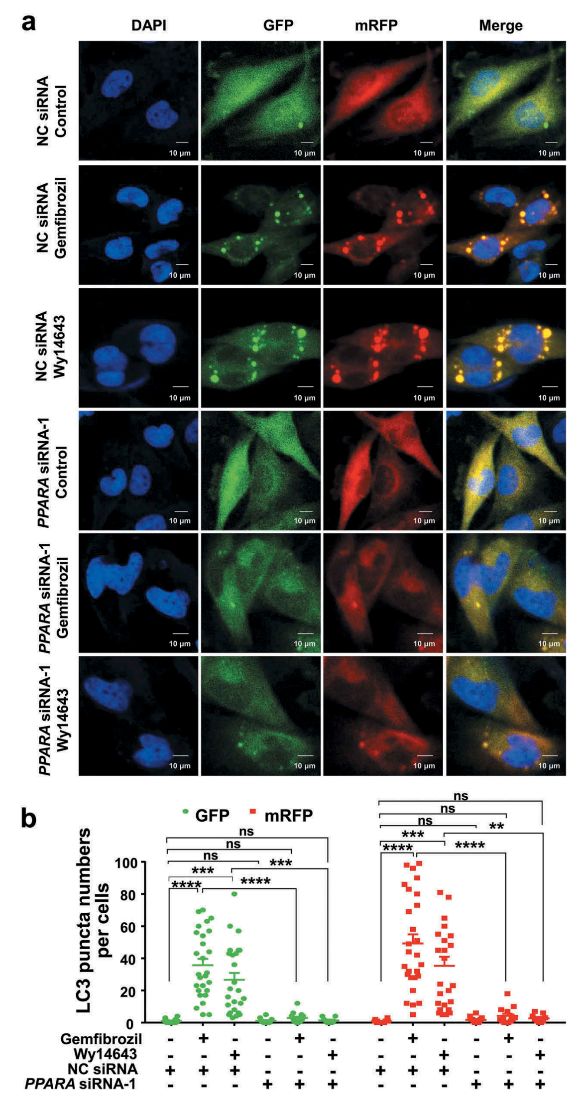
图2.敲低PPARA可以逆转吉非罗齐和匹立尼酸处理引起的HM细胞自噬流增加
小鼠模型层面
在AD小鼠模型层面,作者通过Morris水迷宫实验,发现吉非罗齐和匹立尼酸能显著提升AD模型小鼠的学习与记忆能力(图3)。
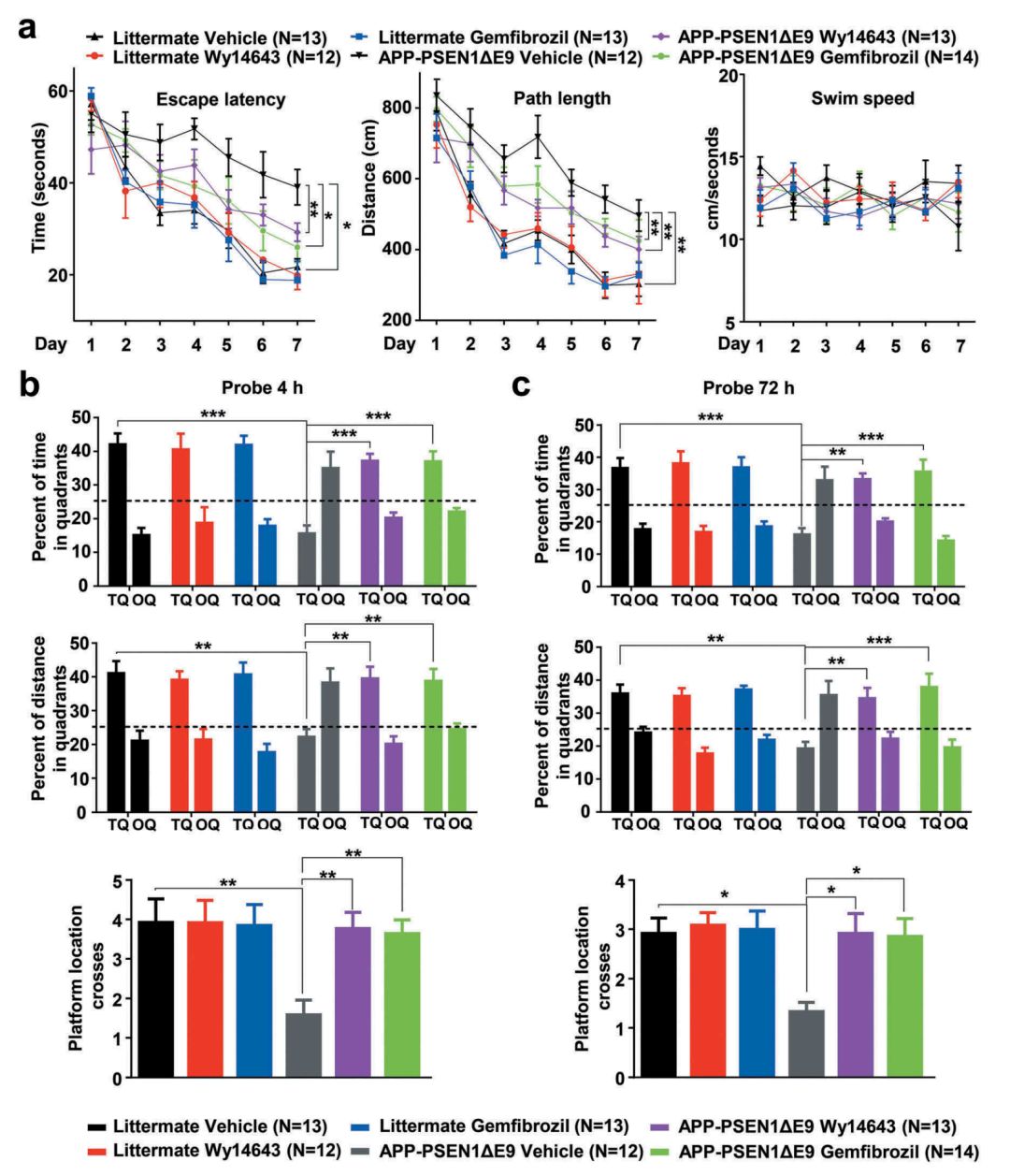
图3.PPARA激动剂能够改善APP-PSEN1ΔE9小鼠空间记忆损伤
证实了PPARA的激动剂确实能够改善AD小鼠的学习与记忆能力后,作者测试了其对神经突触完整性的影响,发现PPARA激动剂能够使AD小鼠皮层和海马的神经元结构可塑性标志物SYP和DLG4/PSD-95显著升高(图4g-h),同时能够使海马脑区神经元树突棘密度显著增加(图4i-j)。
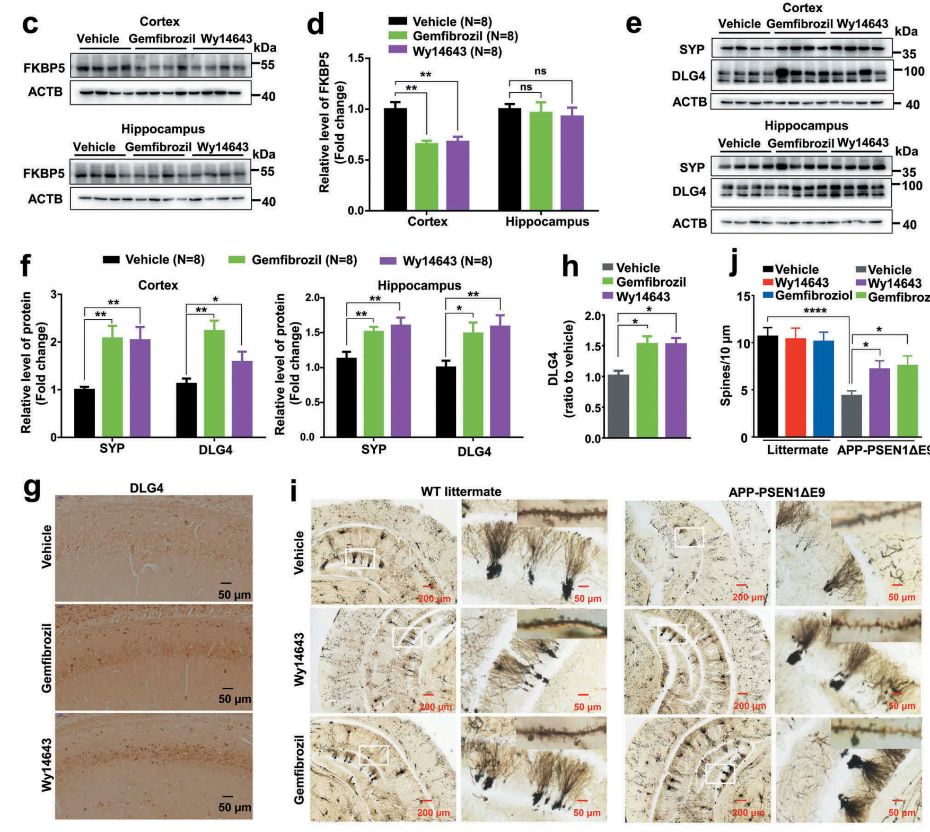
图4.PPARA激动剂能够改善APP-PSEN1ΔE9小鼠结构功能可塑性损伤
那么PPARA激动剂导致的细胞自噬能否改善AD小鼠的病理进程呢?作者发现PPARA激动剂能够显著增加AD小鼠自噬体标志物LC3和溶酶体标志物LAMP1与Aβ(4G8)的共标率(图5f-i),同时能够使U251-APP细胞胞外的Aβ40和Aβ42水平显著降低(图5l),证明了PPARA激动剂激活自噬,在Aβ的清除作用中起重要作用。
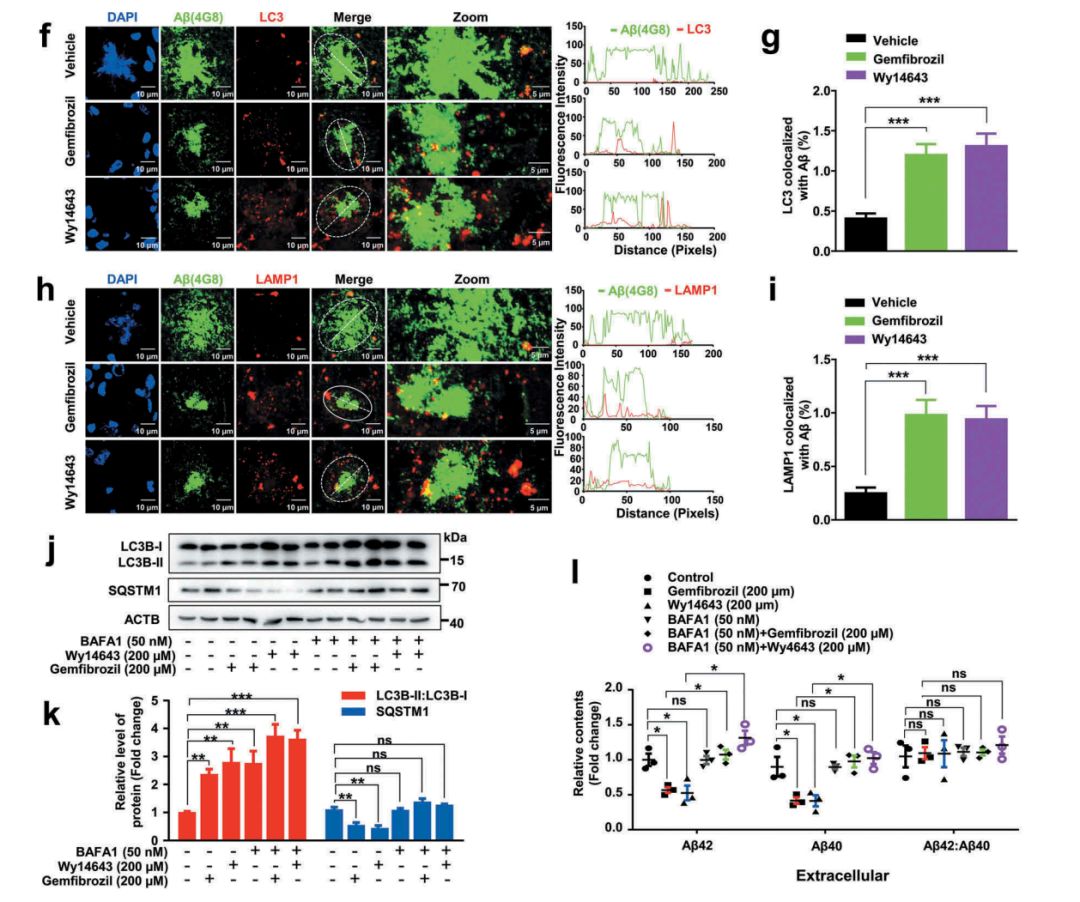
图5. PPARA激动剂引起的自噬能够促进AD小鼠海马和皮层的Aβ清除。
先前的研究报道提示,小胶质细胞和星形胶质细胞在脑内发挥神经保护作用,能够有效清除Aβ,但随AD病程发展,其过度激活会影响其吞噬和清除aβ的能力。那么作者发现PPARA激动剂能够招募AD小鼠Aβ沉积物附近的小胶质细胞和星形胶质细胞,同时小胶质细胞标志物AIF1和星形胶质细胞标志物GFAP与L3的共标率也同时上升,证实PPARA确实时通过自噬活化小胶质细胞和星形胶质细胞,增强对Aβ的清除。
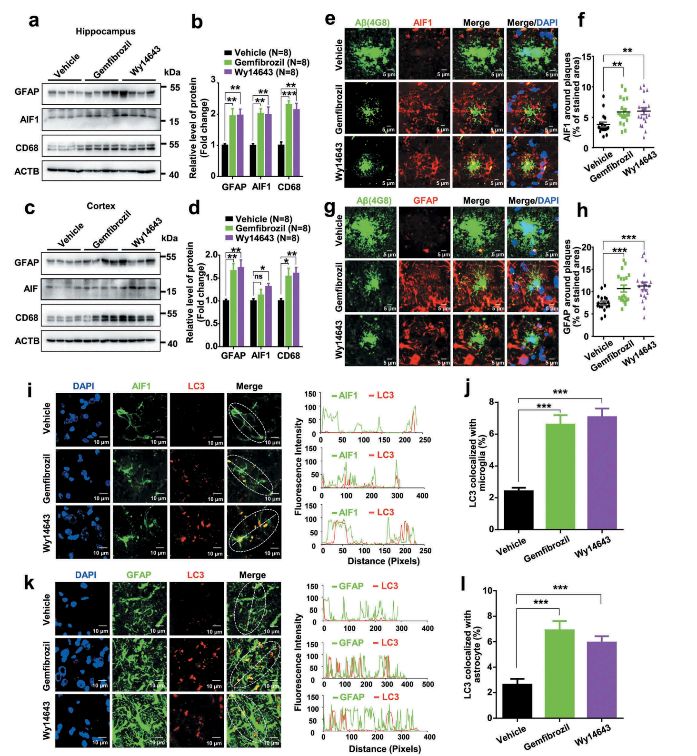
图6.PPARA激动剂激活自噬,广泛招募Aβ附近小胶质细胞和星形胶质细胞
总结
PPARA激动剂吉非罗齐和匹立尼酸可激活自噬,诱导Aβ附近小胶质细胞和星形胶质细胞活化,从而对β-淀粉样蛋白进行清除,提高神经元SYP和DLG4蛋白水平,改善神经元结构和功能,进而改善记忆障碍和焦虑症状。该研究找到了阿尔兹海默症新靶标PPARA,研究为AD防治开辟了新思路。
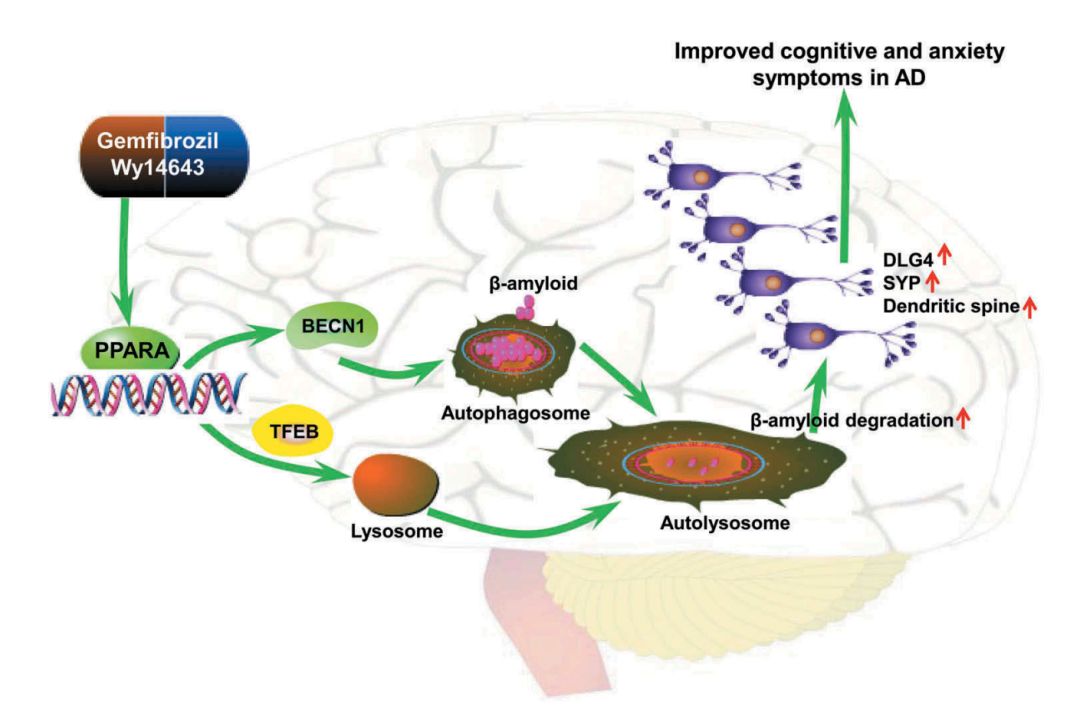
图7.PPARA介导的自噬抗阿尔兹海默症的分子机制
吉凯助力
该研究中慢病毒产品:mRFP-GFP-LC3由吉凯基因提供。通过感染人源小胶质细胞和U251-APP细胞,观察PPARA激动剂对细胞自噬流的影响。
慢病毒感染细胞后很好地监测到了细胞自噬水平的变化,进而佐证PPAPA激动剂能够促进自噬现象(效果见图8)。
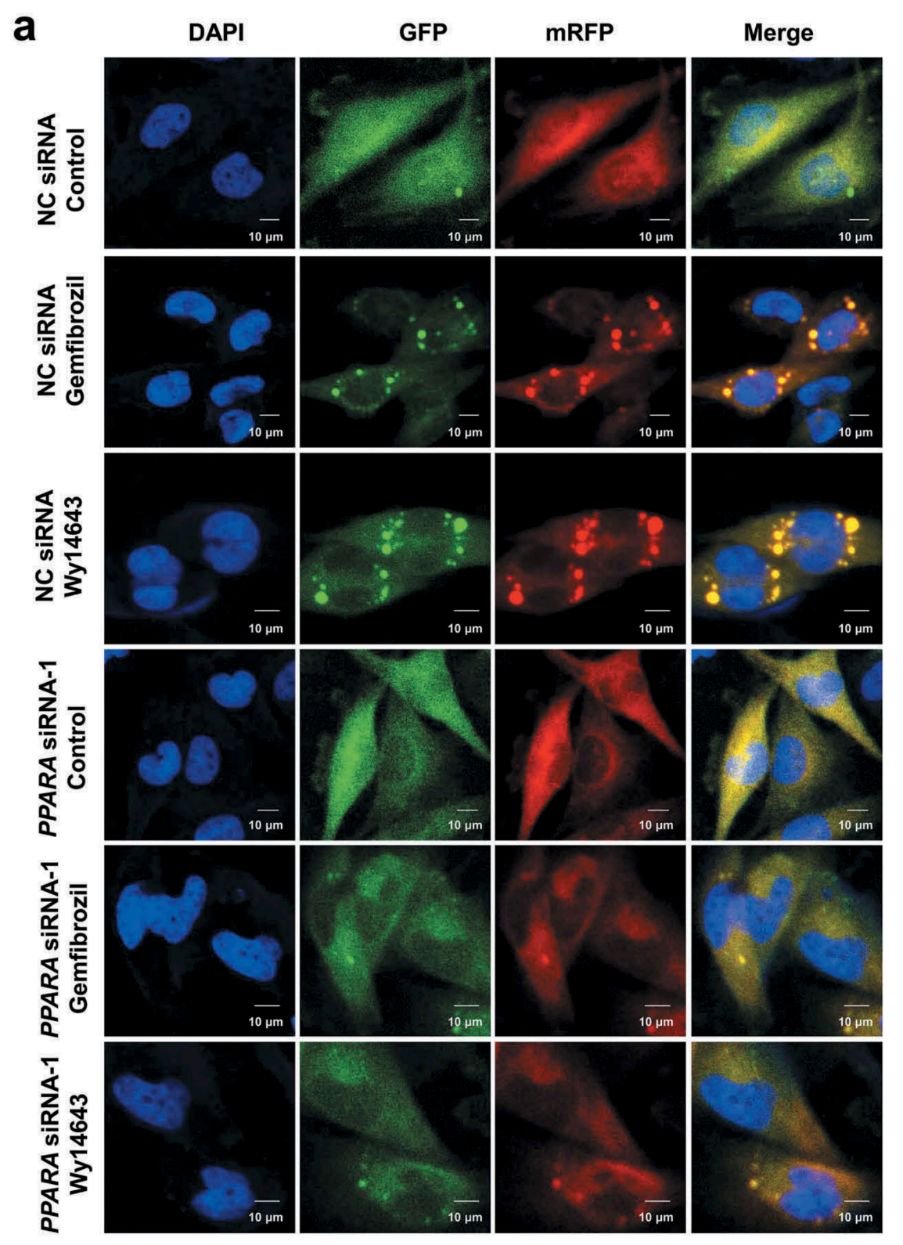
图8. Lv-mRFP-GFP-LC3实时监测细胞自噬水平
