
实验室自建检测对于医疗机构开展未经国家药品监督管理局审批且急需满足临床实践需求的检测具有重要意义。随着近年来肿瘤精准医学的发展,全景变异检测(CGP)已经成为肿瘤患者精准分子分型、靶向治疗、免疫治疗生物标志物等检测的重要手段和方法,但其在医疗机构开展自建检测的标准与应用规范尚缺乏统一的认识与共识。中国抗癌协会肿瘤病理专业委员会分子病理协作组联合中华医学会病理学分会分子病理学组发起了医疗机构开展CGP二代测序(NGS)检测性能确认相关规范中国专家共识,结合中国临床实践,参考国内外文献,从实验室自建的背景、性能确认的场景、评估指标与变异范围,性能确认覆盖的样本类型、数量、临床性能与药效判定,性能确认的场地、人员、质控、室间质评与文档管理等方面进行评述。
经专家组讨论并形成12条专家共识,为中国医疗机构开展肿瘤CGP NGS检测的性能确认和临床应用提供参考,以促进医疗机构自建检测应用的发展。
|
共识编码 |
共识内容 |
|
共识意见 1 |
未经NMPA批准的商品化CGP NGS检测、实验室自行研发的CGP NGS检测,在开展常规检测前应进行性能确认。 |
|
共识意见 2 |
肿瘤CGP NGS的性能确认,应该针对CGP覆盖的常见变异类型选择代表性变异位点,应关注准确性、精密度、分析敏感性、分析特异性和检测限等指标。 |
|
共识意见 3 |
肿瘤CGP NGS的性能确认中,可以针对覆盖的常见复杂生物标志物(如TMB、MSI、HRD等)开展性能确认。 |
|
共识意见 4 |
对于样本类型的选择,性能确认的样本应包含所有变异类型和复杂生物标志物。样本类型可包括携带已知变异的标准品和与预期用途中样本类型一致的临床样本。 |
|
共识意见 5 |
样本数量的选择,针对每种变异类型,应在95%置信度(α=0.05)和95%可靠性(r=0.95)的基础上,使用容忍区间来评估性能确认的最少样本数。 |
|
共识意见 6 |
临床性能确认应结合CGP NGS的预期用途,使用对应癌种和样本类型中变异信息已知的回顾性临床样本,开展临床敏感性和临床特异性检测。 |
|
共识意见 7 |
考虑到可执行性,CGP NGS的临床性能确认需要进行药物有效性和阈值判定时,相关数据可随临床检测的开展进行前瞻性收集。 |
|
共识意见 8 |
已开展过性能确认的CGP NGS检测,当发生任何组成部分的更改都应进行补充确认。补充性能确认应以端到端的完整方式测试多个已知变异样本,确保更改不影响CGP NGS的临床预期用途。 |
|
共识意见 9 |
CGP NGS在医疗机构开展,实验室人员应为具备国家要求的相应的资质的专业人员,高通量测序实验室场地应注意进行合理分区,防止核酸污染和保障生物安全。 |
|
共识意见 10 |
CGP NGS检测在医疗机构实施必须针对特定检测建立质量控制措施,在实施前明确SOP并建立实验和测序质量标准,质量标准一旦建立,不得随意改变。同时,鼓励实验室定期参与适当的能力确认计划,如室间质量评估。 |
|
共识意见 11 |
CGP NGS检测的生物信息学流程性能确认需开发以分析方法学为中心的分析流程。在生物信息学流程性能确认的过程中需要评估数据预处理、数据比对及质控、变异识别和变异注释等步骤的主要标准和参数。 |
|
共识意见 12 |
CGP NGS检测的性能确认记录文档,应包含整个检测流程的标准操作规程文件,包括样本采集与处理、文库制备、测序、数据分析、性能确认结果报告等过程描述。实验人员需应严格遵循标准操作规程。 |
共识意见④指出: 对于样本类型的选择,性能确认的样本应包含所有变异类型和复杂生物标志物。样本类型可包括携带已知变异的标准品和与预期用途中样本类型一致的临床样本。
菁良产品
微小残留病灶(MRD) 质控品套装
● 100%细胞系原料制备,优化的片段化工艺最大程度模拟ctDNA
● 37个热点突变,覆盖常见肿瘤靶向治疗相关基因
● NGS MRD panel与数字PCR验证结果高度一致
梯度突变频率满足MRD LDT流程的检测限验证需求
● ISO9001质量体系认证,质量稳定可靠
热门产品列表

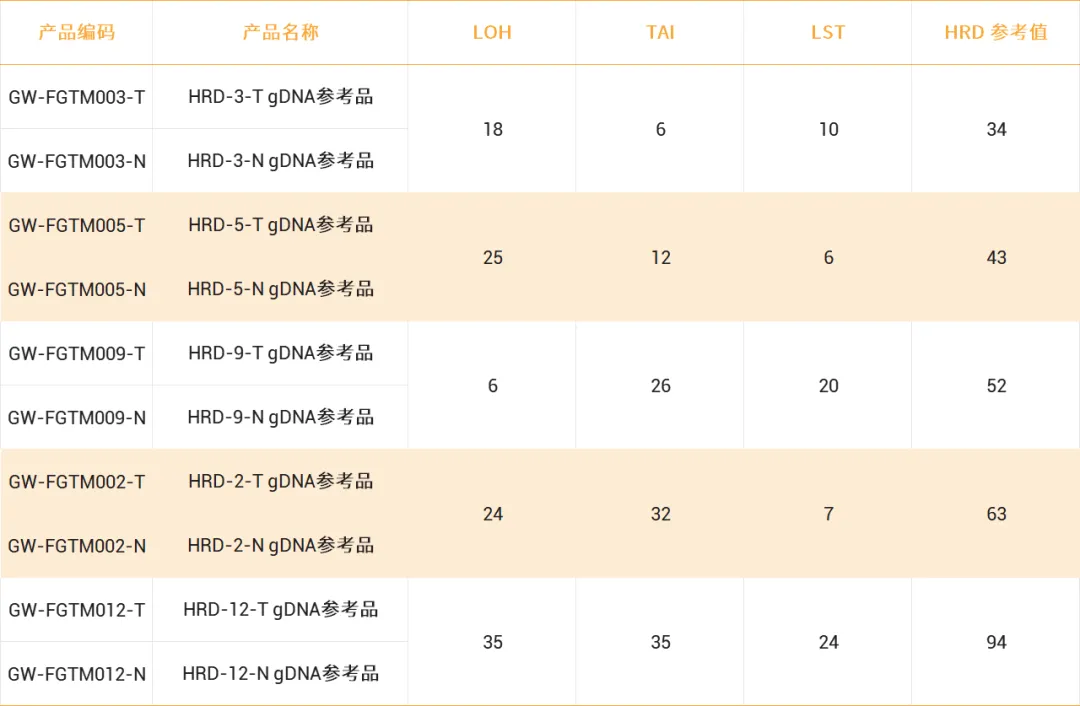
肿瘤突变负荷(TMB)检测标准品
● 细胞来源标准品高度模拟病人样本
● 可提供22对配对细胞系质控品用于过滤胚系突变
● 产品形式丰富:gDNA、ctDNA、FFPE蜡块
● 经过多家行业顶级检测公司测试,结果稳定一致
● 提供标准品配套完整WES数据、TMB分析流程及TMB参考值
● TMB参考值覆盖广,包含从2到28多个梯度
● 可模拟不同肿瘤细胞含量的临床样本
热门产品列表
产品规格:1μg/支,30ng/μL
产品效期:36个月 (2-8℃)
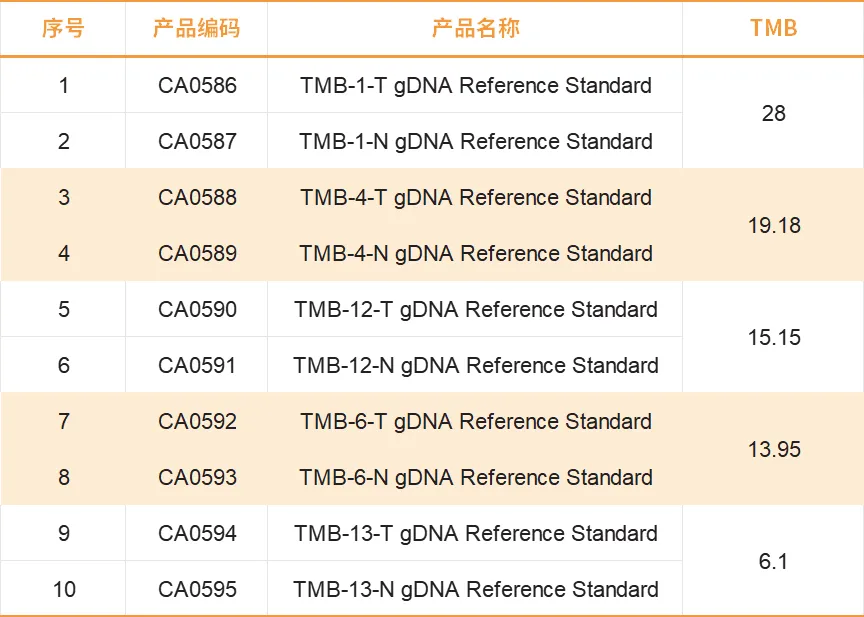
同源重组修复缺陷gDNA质控品
● 参考临床分析流程设计HRD更适合临床客户流程的质量控制
● 流程验证附加Myriad Genetics myChoiceTM HRD plus定值结果
● 以42分作为阈值涵盖阴性和阳性质控品满足不同客户质控品需求
● 适配单样本分析流程满足临床单样本质控需求
热门产品列表
产品效期:36个月 (2-8℃)
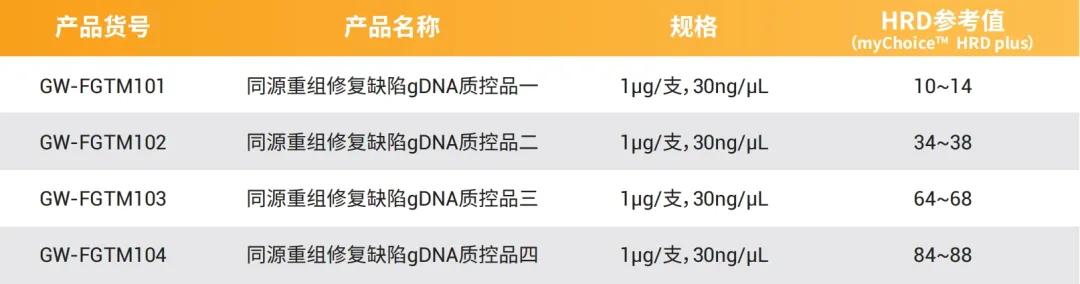
同源重组修复缺陷(HRD) 参考品
● 来源于永生化细胞系,有较好的稳定性及可持续性
● HRD Score分布范围广,能模拟真实样本
● 配对细胞系,适配主流IVD厂商的分析流程
● 可通过不同比例细胞系混合模拟不同肿瘤纯度,为LOD验证提供参考
● 采用WGS数据评估标准品HRD参考值,可用于HRD panel的准确性评估
热门产品列表
产品规格:1μg/支,30ng/μL
产品效期:36个月 (2-8℃)
泛肿瘤800gDNA标准品
● 样本来源于人类细胞系
● 验证位点多(大于320个基因、720个突变)
● 变异类型全,变异位点多为已知数据库位点
● 突变位点频率范围宽(1-100%)
● ddPCR验证位点突变频率呈梯度(1-7%)
● 全外显子测序采用业内公认度极高的捕获芯片及测序平台
● 涵盖位点包含多个国际知名肿瘤检测Panel
热门产品列表

髓系血液瘤gDNA标准品
● 复合程度高,涵盖19个基因的22个突变位点
● 涵盖高频和低频突变,支持Somatic和Germline突变性能验证
● 适配NGS及PCR平台检测流程质控
● 涵盖用药靶点和预后评估位点,为临床检测提供精准质控
● 涵盖常见SNV及Indel突变类型,包含FLT3基因300bp长插入重复序列
热门产品列表

微卫星不稳定性(MSI)参考品
● 细胞来源质控品,高度模拟临床样本
● 提供模拟不同肿瘤纯度,为LOD验证提供参考
● 质控品MSI值有MSS,MSI-H 两种可选
● gDNA/FFPE蜡块/ctDNA等丰富的产品形式
定制产品列表

如需更多产品,可联系菁良客服进行定制。
关于菁良
菁良科技(深圳)有限公司是全球领先的提供体外检测标准品的研发创新型高科技企业。
体外检测需要标准品!随着经济的快速发展,科技细分领域的不断拓展,国民生活水平的不断提高,检验检测市场需求也随之快速上升,体外检测进入高速发展阶段。然而配套的质量控制和规范化意识却相对滞后,很大一部分体外检测方法仍然存在效率低下且检测准确率有限的情况。菁良通过自主研发的高科技平台,向体外检测行业用户及合作伙伴提供全球领先的标准物质、第三方质控产品和研发参考品服务,助力提高行业检测准确率!
菁良自2018年成立以来,始终以推动行业规范化、标准化为己任,参与多项由检测领域行业龙头发起的标准制定工作,多次支持由临检中心发起的室间质量评价 (EQA)/能力验证项目。菁良拥有全球领先的标准品研发技术和资深的国际拓展经验,已推出众多行业首创的参考品和第三方质控品,被广泛用于检测试剂和仪器的工艺开发、以及检测过程之中。菁良秉承着“精准制标、匠心良造”的理念,怀抱着“提高体外检测准确率,助力精准医学快速发展”的愿景,致力于建立规范化的中国体外检测金标准平台。
更多产品信息可点击“阅读原文”查看
也可直接咨询菁良销售及技术支持
|
区域 |
联系方式 |
|
东区销售负责人 |
13795223824 |
|
北区销售负责人 |
13611229766 |
|
南区销售负责人 |
15889963251 |
|
海外销售负责人 |
19804342929 |
|
全国销售总监 |
18501018000 |
|
技术支持热线 |
0755-25167057 |
