很多童鞋做共聚焦成像的时候都会遇到细胞贴壁难的问题。今天分享下如何处理玻璃底培养皿、如何选择玻璃底培养皿,让细胞妥妥地贴壁,大家做共聚焦时候能够更得心应手。
市面上常见的玻璃底培养皿,通常是在塑料培养皿底部打个洞,再将厚度为170-220μm的盖玻片或细胞爬片用无影胶水或硅胶粘于培养皿底部。并不是整个培养皿的底部都是玻璃材质的。适用于观测的区域仅仅在打孔的区域。但是由于玻璃的疏水性,往往在培养细胞的时候,细胞不能在玻璃上很好地贴壁,生长状态并不好,甚至在做共聚焦扫描成像的时候发生细胞脱片的现象。
 |
图1 市面常见玻璃底培养皿
想要细胞好好贴壁,所使用的玻璃底培养皿进行细胞培养之前,要确认已经包被了特定的蛋白试剂。
自己动手包被
培养不同的细胞,需要的包被试剂也不同。同时,因为用于包被的蛋白是生物产物,所以不同公司的包被蛋白的产品纯度和用量都是不同的,本技术帖只是提供参考,具体的包被试剂用量还是要参考所用品牌的说明书。并且最好以自己所用的试剂先做一个梯度实验,找出最适合的包被浓度。
这里以 Poly-L-Lysine 为例(PLL,sigma,P4832, 100μg/ml):
PLL包被适用于绝大多数细胞,尤其适用于中枢系统神经元的培养。在使用时需要使单位面积上的蛋白含量(μg/cm2)达到理想的量。本例中PLL推荐包被的用量为 2μg/cm2。需要根据包被面积,包被体积,来计算所需要蛋白质的量。
比如:35mm玻璃底培养皿,细胞生长面积是3.5cm2,包被面积是4.1cm2,包被液体积是400μl,那根据推荐用量2μg/cm2。那么单孔中需要8.2μg的PLL,如果只加入400μl的PLL溶液,那PLL的溶液浓度为20.5μg/ml(约为 20μg/ml)。所以,需要用超纯水将原液进行稀释。
具体步骤:
1.使用超纯水按照1:5稀释PLL原液。
2.在每个35mm玻璃底培养皿中加入400μl的PLL稀释液。
3.室温孵育1-2小时,吸出PLL稀释液。
4.使用2ml PBS溶液或无血清培养基小心的清洗3次,吸尽清洗液。
5.直接加入细胞悬液进行培养。
方法评价
由于各种包被蛋白的性质不同,不同的包被蛋白使用方法也不一样。经常由于需要对玻璃底培养皿包被,而产生了新的污染。而且污染往往是开始养细胞了以后才会发现,这样不仅耽误了时间,而且也浪费了试剂盒耗材。毕竟包被蛋白试剂和质量有保证的玻璃底培养皿价格也是不菲的(质量不过关的玻璃底培养皿有可能会因为胶水没有粘匀而漏液或者使用的胶水对细胞有毒性)。
无需包被的共聚焦培养皿
对于想节省时间和功夫的童鞋,还是直接使用无需包被的共聚焦培养皿更为方便些。
选择合适的培养皿需要考虑的因素有:是否适合自己的细胞贴壁、培养皿的光学特性是否符合共聚焦要求。
能符合上述因素要求的培养皿,不局限于带包被的玻璃底培养皿,事实上,大家都知道塑料培养皿更便宜、相对玻璃来说,也更容易让细胞贴壁。这里以德国ibidi的共聚焦培养皿为例,说一下符合共聚焦实验的培养皿需要具备哪些参数:
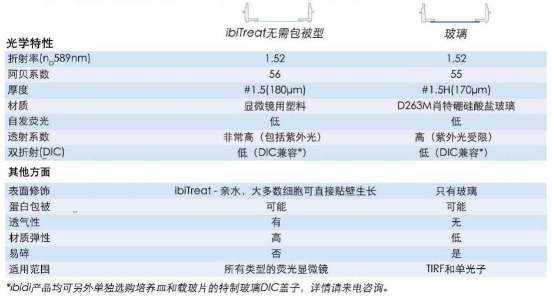
图2 德国ibidi共聚焦培养皿和高质量玻璃底培养皿的底部参数对比
可以看出,符合直接使用要求的共聚焦培养皿,它们的物理参数都是非常接近玻璃的,但同时,它们又还具有亲水的特性,能让大多数细胞更好贴壁;而且透气性和延展性都要比玻璃更好。比如这里举例的ibidi培养皿,就可让绝大多数细胞系和原代细胞直接贴壁生长,而且不易碎,算是不错的选择。
大家也可根据自己具体实验要求,结合上述表格的参数,找到最合适自己实验的共聚焦培养皿。
方法评价
选择这类培养皿,不需要额外包被,大大减少了污染的风险。并且由于塑料底部比较易于加工,不需要胶水就能使其固定在培养皿底部。杜绝了漏液或者细胞毒性的可能。
高通量共聚焦实验耗材
由于单个培养皿通量很小,如果一次要做多个样品,操作就会比较麻烦,且试剂用量会较大,这时候可以选择多孔的耗材,比如腔室载玻片(2/4/8孔),可以满足研究人员需要一次进行多通量的成像。并且相对于传统的共聚焦培养皿,腔室载玻片需要试剂的更少,非常节约价格昂贵的抗体,单孔实验的成本大大降低。

图3 市面的无需包被共聚焦培养皿和腔室载玻片
(图片引用自德国ibidi的81156,80826)
现在也有适用于高内涵显微镜和活细胞工作站的多孔板。适合全自动成像和操作。

图4 市面的高内涵显微镜和活细胞工作站的多孔板
(图片引用自德国ibidi的82406,89626;这个多孔板的壁是黑色的,可以避免成像时候孔间荧光的影响,不错的设计。赞一个~)
*文中图片皆来自网络,如侵权请联系删除。
